您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-11-12 09:14
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
默沙东K药即将在华获批第4个适应症。11月6日,默沙东(MSD)的K药(帕博利珠单抗/Pembrolizumab,商品名:Keytruda/可瑞达)新适应症的上市申请已处于"在审批"状态,预计将于本月获批上市。该适应症是联合化疗一线治疗鳞状非小细胞肺癌(NSCLC),若此适应症顺利获批,则K药将成为国内获批适应症最多的PD-1/L1单抗,这4个适应症分别是二线治疗黑色素瘤、联合化疗一线治疗鳞状NSCLC、联合化疗一线治疗非鳞NSCLC以及一线治疗PD-L1阳性NSCLC。
国内药讯
1.圣济堂格列美脲片通过一致性评价。圣济堂旗下格列美脲片(2mg,圣平)通过一致性评价。格列美脲片(Glimepiride,Amaryl/亚莫利)为第三代磺酰脲类口服降血糖药,为磺酰脲类胰岛素促泌剂。该药原研药由赛诺菲-安万特开发,最早于1995年6月在荷兰获批用于治疗2型糖尿病。目前,国内共有17个格列美脲片生产批文,共有6个厂家,8个品规通过一致性评价。2017年,格列美脲片国内销售额约为人民币9.7亿元。
2.吉利德ASK1抑制剂在华获批临床。吉利德在研ASK1抑制剂selonsertib片获国家药监局临床试验默示许可,拟开发适应症为中晚期糖尿病肾病(DKD)。公开资料显示,2016年,selonsertib在治疗肺动脉高压(PAH)和糖尿病性肾病(DKD)的两项Ⅱ期临床中均未能达到临床终点。2019年2月和4月,其针对非酒精性脂肪性肝炎(NASH)的Ⅲ期临床(STELLAR 3和STELLAR 4)均以失败告终。目前,selonsertib治疗DKD患者的Ⅱ期临床正在进行中。据悉,该研究也未能到达主要终点,但探索性事后分析表明,selonsertib可能减缓糖尿病肾病的进展,且48周内没有剂量依赖性副作用。
3.复星凯特与凡恩世生物建立CAR-T产品战略合作。复星凯特与凡恩世生物达成一项合作协议。根据协议,凡恩世生物将在中国(包括香港、澳门及台湾地区)为复星凯特独家提供针对两个独特肿瘤靶点的多个高亲和力人源化抗体,用于推进创新实体瘤治疗CAR-T产品的开发及商业化。凡恩世生物将有权获得首付款、后续里程碑付款及其它特许权使用费;同时复星凯特将在上述地区以外的全球市场获得上述抗体商业权益的优先权。复星凯特为复星医药与Kite 公司(吉利德旗下公司)的合营企业,致力于开发肿瘤免疫细胞疗法。
4.恒瑞医药收购瑞石医药。恒瑞全资子公司盛迪医药拟以9500万美元收购香港瑞石医药95%股份,其中2000万美元为支付转让对价,7500万美元为注资收购瑞石生物开曼群岛公司95%股权,从而间接持有中国香港瑞石生物95%股权。上海盛迪医药设有恒瑞新药研发、临床研究、专利注册、医学事务及产品市场管理等核心部门。
5.和誉医药与阿斯利康达成一项合作协议。和誉生物与阿斯利康就创新药AZD4547的开发和商业化达成全球性独家授权协议。AZD4547是阿斯利康开发的一款强效、高选择性的口服小分子FGFR1/2/3抑制剂。目前正在美国及欧洲开展多项针对实体肿瘤的Ⅰ/Ⅱ期临床试验。在临床前研究中,AZD4547在相关肿瘤模型中单药效果显著,并在FGFR基因异常的肿瘤患者中展现出明显的药效。根据协议,和誉医药获得AZD4547全球独家开发、生产以及商业化的许可。阿斯利康将获得相应的首付款、里程碑及销售提成。
国际药讯
1.Cassiopea SpA创新机制痤疮新药获FDA受理。Cassiopea SpA公司宣布,其用于治疗痤疮的clascoterone(1%浓度)霜的新药申请获FDA受理,PDUFA日期为2020年8月27日。Clascoterone(CB-03-01)是一种具创新机制的局部雄激素受体抑制剂,该药物正在开发治疗痤疮(Winlevi)和男女性脱发(Breezula)。在两项关键III期临床中,痤疮患者接受Winlevi或安慰剂的治疗,其长期安全性结果显示,在第12周的IGA 评分,以及在第12周每个治疗组非炎症病变计数、炎症病变计数基线的绝对变化等方面,治疗组均显示出统计学意义的显著改善。
2.强生2针埃博拉疫苗方案在欧盟进入加速评估。强生旗下杨森宣布,已向欧洲药品管理局(EMA)提交了2份营销授权申请(MAA),申请批准埃博拉疫苗方案用于预防由扎伊尔埃博拉病毒株引起的埃博拉病毒病(EVD)。2份MAA已被平行提交,支持2针免疫方案中的每种疫苗(Ad26.ZEBOV,MVA-BN-Filo)。今年9月,EMA人用医药产品委员会(CHMP)已授予这些申请加速评估资格。该疫苗方案为:(1)将Ad26.ZEBOV作为第一针免疫疫苗,该疫苗基于杨森的AdVac技术开发;(2)大约8周后,将MVA-BN-Filo作为第二针免疫疫苗,该疫苗基于Bavarian Nordic公司的MVA-BN技术。
3.基因泰克CD20抗体治疗狼疮性肾炎最新结果。罗氏旗下基因泰克公司的抗CD20抗体Gazyva(obinutuzumab)在治疗增生性狼疮肾炎的Ⅱ期临床NOBILITY中达主要终点。在接受治疗52周到76周之间,Gazyva+标准疗法治疗组中达到完全肾脏缓解的患者比例显著优于对照组(40%,对照组为18%,p=0.007);Gazayva还提高了患者的总肾脏缓解率;Gazyva的严重不良反应发生率为24%(对照组为29%),严重感染率发生率为6%(对照组为18%)。详细数据在美国风湿病学院年会上公布。Gazyva此前已获FDA批准治疗慢性淋巴细胞白血病。
4.罗沙司他安全性试验结果积极。阿斯利康与珐博进发布罗沙司他(roxadustat)的汇总心血管(CV)安全性分析。在非透析依赖性(NDD)肾性贫血患者中,与安慰剂相比,罗沙司他没有提高主要心血管不良事件(MACE)、需要住院的不稳定型心绞痛和需要住院的充血性心力衰竭事件(MACE+)以及全因死亡率。在透析依赖性(DD)肾性贫血患者中,与标准疗法红细胞生成素相比,没有提高MACE、MACE+和全因死亡率。在随机分组前四个月内开始接受透析的患者(ID)中,与血红细胞生成剂相比,罗沙司他组的MACE风险降低30%,MACE+风险降低34%,全因死亡率也有所下降。
5.美国首个CRISPR编辑T细胞疗法初步临床结果积极。宾夕法尼亚大学Abramson癌症中心Stadtmauer教授团队的基于CRISPR技术编辑T细胞的TCR-T疗法,在第61届美国血液学会年会上公布其临床试验的初步数据。这是美国首个在癌症患者中检测被CRISPR编辑过的免疫细胞安全性的临床试验。2例多发性骨髓瘤患者和1例肉瘤患者分别在1月、4月以及8月接受TCR-T疗法治疗,患者目前都还存活。没有出现神经毒性或细胞因子释放综合征。其中1例患者病情稳定。序列qPCR用于检测外周血中慢病毒转录本的拷贝以及患者的肿瘤活检,显示了T细胞在体内的扩增,稳定持久存活以及对肿瘤的靶向性。
6.辉瑞/默克PD-L1胃癌维持治疗研究失败。辉瑞和默克的PD-L1肿瘤免疫疗法Bavencio在难治性胃癌的Ⅲ期维持治疗研究(Javelin Gastric 100)中失败。处于晚期或无法进行手术的胃癌患者在成功进行了一轮化学疗法后,与继续化疗或延长患者生命的最佳支持治疗相比,Bavencio未能击败其他两种治疗方案。即使在PD-L1阳性患者中,Bavencio也没有展现出良好的治疗优势。该药此前已获FDA批准上市,联合辉瑞的靶向抗癌药Inlyta用于晚期肾细胞癌患者的一线治疗。
医药热点
1.中医药临床研究有了规范。中华中医药学会标准办公室发布国内首个《中医药临床研究数据监查技术规范》。该《规范》由中国中医科学院中医临床基础医学研究所提出,东南大学、北京中医药大学、天津中医药大学等多家单位联合起草,填补了我国中医药临床研究质量控制和质量保证体系的空白。在中医药临床研究中引入国际通用的全过程、全覆盖、全跟踪的动态临床研究数据监查方法,提高中医药临床研究质量,加速中医药临床研究与国际接轨。
2.国家神经疾病中心有了标准。国家卫健委发布《国家神经疾病中心设置标准》和《国家神经疾病区域中心设置标准》。文件明确,国家神经疾病中心应为三级甲等综合医院,相关科室设置齐全,应包括神经内科、神经外科与神经康复科等。具备独立的重症监护室,其床位数占科室床位总数≥8%;近3年,年均重症病例数至少2000例。在医疗服务能力方面,要已建成系统的神经系统常见病与罕见病、疑难危重症诊疗平台,并能够利用多项核心技术开展诊疗。
3.河南为农村全科医生评副高松绑。日前,河南省人社厅印发《关于进一步做好农村全科医生副高级职称考核认定工作的通知》。《通知》明确,对长期扎根农村基层工作的全科医生,经过考核认定直接聘任副高级职称,不受岗位结构比例限制。取得的副高级职称限定在乡镇卫生院、村卫生室等农村医疗卫生机构聘任。其中,全科专业住院医师规范化培训合格或执业范围为全科专业的临床医生,取得全科医学或全科医学(中医类)中级职称后,在农村医疗卫生机构连续工作满10年,免职称业务考试。
【科伦药业】1)子公司科伦制药的肝素钠封管注射液获得《药品注册批件》,用于维持静脉内注射装置的管腔畅通。2)公司化学药品阿哌沙班片获得《药品注册批件》,用于髋关节或膝关节择期置换术的成年患者,预防静脉血栓栓塞事件(VTE)。
【方盛制药】公司拟以自有资金受让康莱健康持有的佰骏医疗26.65%的股权,并对佰骏医疗进行现金增资;上述股权受让及增资扩股完成后,公司将直接持有佰骏医疗33.92%的股权,并通过同系方盛医疗基金间接持有佰骏医疗17.08%的股权,合计持有佰骏医疗51%的股权。佰骏医疗将纳入公司合并报表范围内,成为公司控股子公司。
【通化金马】 公司已通过高新技术企业认定审查并收到《高新技术企业证书》,被认定为高新技术企业。
审评动向
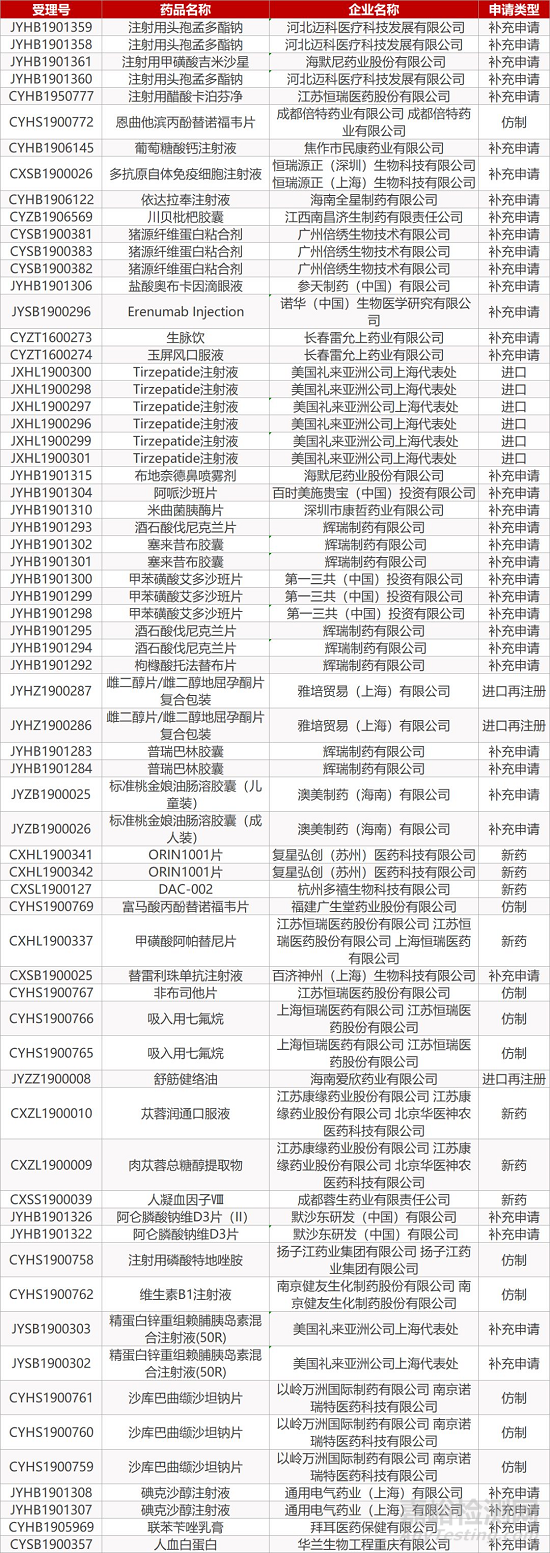
1. CDE最新受理情况(11月11日)
2. FDA最新获批情况(北美11月09日)
暂无

来源:药研发


