您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-10-30 09:05
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:16条资讯,阅读时长约:3分钟 」
今日头条
安进双特异性抗体Blincyto在华申请上市。安进(Amgen)双特异抗体重磅药——注射用倍林妥莫双抗(blinatumomab ,Blincyto)在我国提交了上市申请(JXSS1900060)。Blincyto是安进开发的BiTE免疫疗法,已获批治疗复发/难治性B细胞急性淋巴细胞白血病(ALL)患者,是FDA批准的首款通过人体T细胞来毁灭白血病细胞的药物。目前市场上获批在售的两款双特异性抗体为:安进的blinatumomab以及罗氏的emicizumab。2018年,blinatumomab的全球销售额为2.3亿美元,emicizumab的全球销售额为2.34亿瑞士法郎。
国内药讯
1.海正药业门冬胰岛素注射液上市申请获受理。海正药业门冬胰岛素注射液用于治疗糖尿病的上市申请获国家药监局受理。门冬胰岛素是一种速效的人胰岛素类似物,该药原研药诺和锐®(NovoLog® )由诺和诺德开发,1999年在欧洲获批上市,2002年获批进口中国。2018年其全球销售额为29.7亿美元,中国市场销售额达2.3亿美元。目前国内尚无国产门冬胰岛素注射液上市。
2.恒瑞1类新药氟唑帕利申报上市。恒瑞1类新药氟唑帕利胶囊上市申请获国家药监局受理,同时申报上市的还有4类仿制药舒更葡糖钠注射液。氟唑帕利属于PARP抑制剂。目前全球共有4个PARP抑制剂上市,2018年全球市场规模在10亿美元左右。2018年8月,阿斯利康奥拉帕利在中国获批上市,成为国内首款小分子靶向PARP抑制剂。恒瑞氟唑帕利有望成为国内第二个获批的PARP抑制剂。Insight数据库显示,恒瑞的氟唑帕利还有10多项临床正在开展,适应症涉及小细胞肺癌、实体瘤、复发转移三阴乳腺癌等。
3.鸿运华宁格鲁塔珠单抗注射液获批临床。鸿运华宁重组抗人GLP-1受体人源化单克隆抗体注射液(格鲁塔珠单抗注射液,GMA105)获国家药监局批准,即将开展针对成人超重或肥胖症的临床试验。格鲁塔珠单抗注射液是鸿运华宁采用专有的GPCR抗体技术平台,自主开发的全新、长效GLP-1受体激动剂。该药已在澳大利亚完成了早期临床试验,结果显示安全性良好,半衰期超过1周,有望开发成每周给药1次的减肥药物。
4.必贝特首创双靶点抗癌药获批临床。必贝特医药具首创全新化学结构的HDAC/PI3K双靶点1类新药BEBT-908获国家药监局临床试验默示许可,拟用于治疗复发或难治弥漫大B细胞淋巴瘤。据悉,BEBT-908可选择性抑制具有协同作用肿瘤细胞信使核心靶点,破坏肿瘤细胞信使网络,显著抑制淋巴瘤和骨髓瘤生长或导致肿瘤消退。与其他已经报道的PI3K抑制剂和HDAC抑制剂相比,BEBT-908的活性更高。
5.昆药重组抗RANKL单抗注射液临床申请获受理。昆药旗下重组抗RANKL全人源单克隆抗体注射液的临床申请获国家药监局受理,临床适应症为:高危骨折风险的绝经期女性骨质疏松症。该药原研药地诺单抗注射剂由安进开发,已在美国等多个国家获批上市,2019年5月在中国获有条件批准上市,规格为120mg/瓶,用于骨巨细胞瘤不可手术切除或者手术切除可能导致严重功能障碍的成人和骨骼发育成熟的青少年患者治疗。目前针对骨折风险增加的绝经后妇女骨质疏松症的地诺单抗还没在国内获批上市。2018年,地诺单抗全球销售额约40亿美元。
6.东曜药业通过港交所聆讯。致力于开发及商业化创新型肿瘤药物的东曜药业于10月27日通过了港交所聆讯。东曜药业成立于2009年,拥有针对各类癌症的综合性在研肿瘤药物组合,包括多种单抗药物、抗体偶联(ADC)药物和溶瘤病毒药物等。目前该公司在研管线中有7个在研生物药和5个在研化学药物。其中,4个在研生物药处于临床阶段。进展最快的在研药物TAB008是一款贝伐珠单抗的生物类似药,正处于Ⅲ期临床阶段,预计2020年底或2021年初推出该产品。
国际药讯
1.PD-L1组合方案在欧盟首次获批一线治疗肾细胞癌。辉瑞(Pfizer)和默克雪兰诺联合宣布,欧盟批准其PD-L1肿瘤免疫疗法Bavencio(avelumab)联合阿昔替尼一线治疗成人晚期肾细胞癌。这是欧盟首次批准PD-L1药物用于治疗肾细胞癌。一项III期JAVELIN Renal 101 研究的期中分析结果显示,与阿昔替尼单药相比,avelumab联合阿昔替尼一线治疗晚期RCC患者(不考虑PD-L1表达水平)可以使疾病进展或死亡风险降低31%(HR: 0.69 [95% CI: 0.574–0.825; p<0.0001]) ,使客观应答率几乎翻倍(52.5% vs 27.3%)。
2.阿斯利康PD-L1组合疗法一线治疗肺癌达Ⅲ期终点。阿斯利康(AstraZeneca)PD-L1单抗Imfinzi(durvalumab)和化疗构成的组合疗法,与添加抗CTLA-4抗体tremelimumab的三重组合疗法,在一线治疗IV期(stage 4)的PD-L1表达的不携带EGFR或ALK基因突变的非小细胞肺癌(NSCLC)患者的Ⅲ期临床试验POSEIDON中,达主要终点和关键性次要终点。与单独化疗相比,Imfinzi+化疗的组合疗法和添加tremelimumab的三重疗法都使患者的无进展生存期具统计学意义的显著改善。详细数据将于未来的医学会议上公布。Imfinzi此前已获FDA批准,治疗经治晚期膀胱癌患者和经治III期(stage 3)无法切除的NSCLC患者。
3.武田布地奈德口服混悬剂达III期研究终点。武田评估TAK-721(布地奈德口服混悬剂,BOS)治疗嗜酸性粒细胞性食管炎(EoE)在两项关键III期研究的首个研究中达到了共同主要和关键次要疗效终点。治疗12周后,与安慰剂相比,BOS治疗组组织学应答者和吞咽困难症状应答者比例显著更高(组织学应答者比例:53.1% vs 1.0%,p<0.001;吞咽困难症状应答者比例:52.6% vs 39.1%,p=0.024);BOS治疗组基线平均DSQ评分的改善显著更大(-13.0分 vs -9.1分,p=0.015);BOS治疗组(n=202)平均EREFS评分的改善也显著更大(-4.0分 vs -2.2分,p<0.001。BOS是一种新型黏膜粘附性局部皮质类固醇制剂。
4.Mirum选择性ASBT抑制剂maralixibat再获突破性疗法认定。Mirum 公司选择性ASBT抑制剂maralixibat获FDA授予突破性疗法认定,用于治疗1岁及以上Alagille综合症(ALGS)儿童患者的瘙痒症状。一项Ⅱb期临床ICONIC的结果显示,与安慰剂相比,接受maralixibat治疗的ALGS儿童患者的sBA水平较基线时显著下降;患者的瘙痒(ItchRO)评分,瘙痒划伤指数(CSS)等指标也得到改善。该药此前已获FDA授予突破性疗法认定,用于治疗2型进行性家族性肝内胆汁淤积症(PFIC)患者。
5.Mirati首次公布KRAS抑制剂临床数据。Mirati 公司KRAS G12C抑制剂MRTX849在治疗携带KRAS G12C基因突变的非小细胞肺癌(NSCLC)和结直肠癌(CRC)患者的Ⅰ/Ⅱ期临床MRTX849-001中获积极结果。接受最高剂量MRTX849(600 mg每天两次)治疗的5例NSCLC患者中3例(3/5)获部分缓解,2例CRC患者中1例(1/2)获部分缓解。在接受所有剂量治疗的患者中,3/6能被评估的NSCLC患者,和1/4能被评估的CRC患者达部分缓解。详细结果在第31届国际分子靶标与癌症治疗大会上公布。目前,该公司开始扩展接受剂量为600 mg每日两次的MRTX849治疗的患者群。
6.Merus双特异性抗体MCLA-128初步临床结果积极。Merus公司HER2/HER3双特异性抗体MCLA-128(zenocutuzumab)在治疗携带NRG1基因融合的癌症患者中获积极的初步临床结果。在第31届国际分子靶标与癌症治疗大会上公布的数据表明,MCLA-128在3例接受治疗的患者中达到缩小肿瘤体积的效果。其中,1例胰腺癌患者在治疗8周后肿瘤直径缩小44%,5个月后直径缩小54%,达部分缓解。另1例已接受过6种不同前期疗法的NSCLC患者治疗5个月后肿瘤直径减小41%,而且脑转移瘤得到改善。
医药热点
1.北大科学家找到治疗艾滋病和白血病新方法。来自北京大学-清华大学生命科学联合中心邓宏魁研究组、解放军总医院第五医学中心陈虎研究组及首都医科大学附属北京佑安医院吴昊研究组的研究人员通过联合研究发表了题为“CRISPR-Edited Stem Cells in a Patient with HIV and AcuteLymphocytic Leukemia”(利用CRISPR基因编辑的成体造血干细胞在患有艾滋病合并急性淋巴细胞白血病患者中的长期重建)的研究论文,这项研究成果标志着世界上首例通过基因编辑干细胞治疗艾滋病和白血病患者的案例由我国科学家成功完成了。研究论文刊登在国际杂志The New England Journal of Medicine上。
2.北京将建示范性研究型病房。北京市卫健委等六部门共同发布《北京市关于加强研究型病房建设的意见》。《意见》明确,北京市计划用3年左右时间,在具有药物和医疗器械临床试验资格的医院择优实施研究型病房建设项目。2019年,启动研究型病房规范化建设,试点建设5个左右示范性研究型病房;到2020年,新建20个左右示范性研究型病房;到2022年,建成若干研究型病房。对纳入建设规划的示范性研究型病房,北京市级财政将给予一次性建设经费补贴和基于考核结果的奖励经费保障。
3.沈阳诊所发展路径明确。辽宁省卫健委等六部门联合印发《开展促进沈阳市诊所发展试点工作实施方案》。《方案》明确,医疗机构设置规划对诊所不做限制,取消诊所设置审批制度,改为备案制管理。鼓励在医疗机构执业满5年,取得中级及以上职称资格的医师,全职或兼职开办专科诊所;鼓励不同专科医师举办专科医师联合诊所;鼓励社会力量举办连锁化、集团化诊所。并要求在2020年6月底前,各区、县(市)级卫健行政部门应至少确定1家~2家诊所,将其纳入可以提供家庭医生签约服务的医疗机构范围。
股市资讯
.
上个交易日 A 股医药板块 +0.39%
涨幅前三 跌幅前三
顺 利 办 +10.02% 汉森制药 -5.52%
司 太 立 +10.00% 山大华特 -5.42%
华海药业 +7.22% 华北制药 -4.91%
【戴维医疗】“一次性使用脐带剪断器”获得医疗器械注册证。
【复星医药】2019Q1-Q3实现营业收入212.28亿元(+17.01%),归母净利润20.64亿元(-1.45%),扣非归母净利润17.22亿元(+8.21%);2019Q3实现营业收入70.55亿元(+12.28%),归母净利润5.48亿元(+2.61%),扣非归母净利润5.55亿元(+41.88%)。
【泰格医药】全资子公司香港泰格拟自筹资金约1,774.33万美元购买EPS控股有限公司的140万股普通股,EPS将通过转让库存股的方式将该部分股权转让给香港泰格。本次交易完成后,香港泰格将长期持有EPS 3.06%的股权。
审评动向
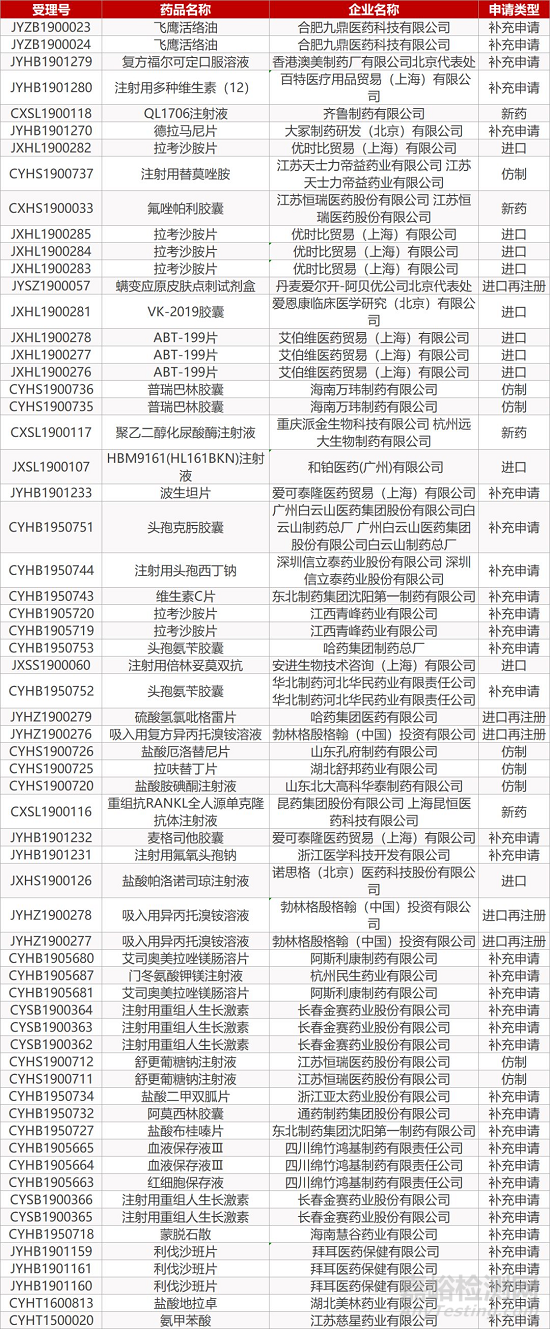
1. CDE最新受理情况(10月29日)
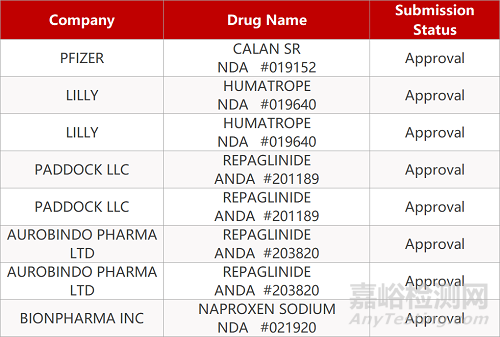
2. FDA最新获批情况(北美10月28日)

来源:药研发


