您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-09-18 09:09
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
扬子江甲钴胺片首家通过一致性评价。扬子江旗下甲钴胺片(0.5mg)首家通过一致性评价。甲钴胺是维生素B12的衍生物,属于抗贫血药,适用于糖尿病周围神经病变及其它神经末梢麻木等病症。该药原研药由卫材开发,最早于1979年获批上市,1998年获批进口中国,商品名:弥可保。目前国内市场上市销售的甲钴胺包括片剂、注射剂、胶囊剂等剂型,其中片剂占68.19%,国内有17家药企持有甲钴胺片生产批文。甲钴胺在国内的市场预计已超过10亿元规模。
国内药讯
1.新华制药头孢拉定胶囊首家通过一致性评价。新华制药头孢拉定胶囊(0.25g)首家获一致性评价批件。头孢拉定属β-内酰胺类抗生素,该药原研药由BRISTOL MYERS SQUIBB公司开发,最早于1982年01月获FDA批准上市,商品名为VELOSEF(0.25g 、0.5g),1997年其原研地产化产品(泛捷复®,0.25g/0.5g)在中国获批上市,持证商和生产厂家均为中美上海施贵宝。目前,该品种已获批上市的企业有新华制药、齐鲁制药等。2018年度头孢拉定制剂全球销售额约为6810万美元。
2.徐诺药业艾贝司他联合疗法全球Ⅲ期进展。徐诺药业在研泛HDAC抑制剂艾贝司他与培唑帕尼联用,一线或二线治疗局部晚期或转移性肾细胞癌(RCC)Ⅲ期临床首例中国患者入组。该项试验正在包括北京肿瘤医院在内的全国17家肿瘤医院进行,北京肿瘤医院肾癌&黑色素瘤内科主任郭军教授为主要研究者。该联合疗法此前已获FDA的快速审批资格。一项Ⅰb期研究结果显示了该方案可控的毒副作用和良好的抗肿瘤活性。目前,该联合疗法一线或二线治疗RCC的全球关键性Ⅲ期临床研究正在进行当中。
3.恒瑞医药SHR-1316注射液获批临床。恒瑞医药SHR-1316注射液、盐酸伊立替康脂质体获国家药监局批准,即将开展盐酸伊立替康脂质体联合SHR-1316及5-FU用于一线治疗晚期食管癌的临床试验。SHR-1316是PD-L1单抗药物,可以解除PD-L1介导的免疫抑制效应,增强T细胞的功能,调动免疫系统清除体内肿瘤细胞。盐酸伊立替康脂质体注射剂利用实体瘤的ERP效应及脂质体对淋巴系统的定向性,改变药物在机体组织中的分布,实现药物的靶向释放,该药品联合氟尿嘧啶和甲酰四氢叶酸,可用于治疗已使用吉西他滨化疗不佳的转移性胰腺癌。
4.神州细胞拟在科创板IPO。神州细胞拟在科创板IPO募资19.82亿元,分别用于产品临床研究项目以及补充流动资金。神州细胞是一家创新型生物制药研发公司,专注于恶性肿瘤、自身免疫性疾病、感染性疾病和遗传病等多个疾病治疗和预防领域的生物药产品研发和产业化。根据招股说明书,目前该公司拥有从靶点蛋白到同类最佳(Best-in-Class)候选生物药的上游技术平台,研制一系列创新生物药品种。其中,6项核心产品(SCT800、SCT200、SCT-I10A等)已获准开展Ⅱ期及Ⅲ期临床试验。
5.博雅辑因完成Pre-B2轮融资。基因编辑生物科技公司博雅辑因完成8150万人民币的Pre-B2轮融资,由A轮领投方IDG资本及Pre-B轮领投方礼来亚洲基金共同投资。博雅辑因致力于使用基因组编辑技术为传统疗法难以治愈的疾病开发新的疗法,以及为新药研发提供更创新的方案。同时,博雅辑因还启动一项新的研发合作以拓展异体T细胞癌症疗法。合作公司是一家临床阶段的致力于开发创新T细胞疗法的生物制药公司。此次合作具体条款及合作公司名称未披露。此轮融资博雅辑因将继续推进其研发管线至下一阶段。
国际药讯
1.诺华CD20抗体疗效优于常见疗法。诺华公布CD20抗体ofatumumab(OMB157)治疗复发多发性硬化症(RMS)患者的Ⅲ期临床ASCLEPIOS研究详细结果。该研究评估ofatumumab与teriflunomide相比治疗MS成人患者的疗效与安全性。结果显示,与活性对照组相比,ofatumumab在两项试验中分别使MS的年复发率降低50.5%和58.8%;3个月后的MS确认残疾进展风险(CDP)降低34.4%,6个月后的这一数字为32.5%。此外,ofatumumab的安全性与此前研究一致。诺华预计于年底向FDA递交监管申请。ofatumumab有望成为首款可在家自行使用的治疗RMS的B细胞疗法。ofatumumab此前已获FDA批准用于治疗白血病。
2.阿斯利康达格列净获快速通道资格。阿斯利康(AstraZeneca)SGLT2抑制剂达格列净(dapagliflozin,Farxiga)获FDA授予治疗心力衰竭成人患者的快速通道资格。一项Ⅲ期临床DAPA-HF结果显示,无论是否患有2型糖尿病,心衰患者都可以从达格列净的治疗中获益。达格列净能够将心衰患者的心衰加重事件和心血管死亡风险降低26%,包括将心衰加重风险下降30%,将心血管死亡风险下降18%。在非2型糖尿病患者中达格列净能够将心衰风险降低27%,与2型糖尿病患者队列相当。达格列净此前已获FDA批准,结合饮食和锻炼,用于改善2型糖尿病患者的血糖控制,并降低他们的体重和血压。
3.Seattle Genetics/安斯泰来创新ADC获优先审评资格。Seattle Genetics和安斯泰来联合开发的抗体偶联药物(ADC)enfortumab vedotin的上市申请获FDA受理,FDA同时授予其优先审评资格。Enfortumab vedotin是一款将抗Nectin-4单抗与微管破坏剂MMAE连接起来的ADC,拟用于治疗局部晚期或转移性尿路上皮癌患者。该疗法此前已获FDA授予突破性疗法认定。一项Ⅱ期临床EV-201结果显示,enfortumab vedotin治疗患者(接受过PD-1/L1治疗和铂基化疗)的客观缓解率达44%,其中完全缓解达12%。缓解持续时间达7.6个月。中位总生存期达11.7个月,中位无进展生存期达5.8个月。目前,这一疗法正处于Ⅲ期临床阶段。
4.生物技术公司Inotrem完成B轮融资。Inotrem公司完成3900万欧元B轮融资。本次融资由Morningside Ventures领投。Inotrem公司成立于2013年,专注于TREM-1途径开发用于治疗急慢性炎症综合征的免疫疗法。该公司的在研特异性TREM-1抑制剂Nangibotide是一种抗TREM-1肽,主要用于治疗慢性炎症性疾病,如感染性休克和心肌梗死等。在临床前脓毒性休克模型中,Nangibotide能够在一定程度上减轻炎症反应、恢复血管功能,并提高动物脓毒性休克后的存活率。本次融资Inotrem公司将用于推进Nangibotide针对脓毒性休克患者的IIb期临床。
5.丹麦灵北拟19.5亿美元收购Alder公司。灵北拟以金额高达19.5亿美元(约130亿丹麦克朗)收购Alder公司。Alder是一家专注于偏头痛治疗性抗体研发的生物制药公司,目前正在开发一款靶向降钙素基因相关肽(CGRP)的单克隆抗体eptinezumab,如果获FDA批准(2019年2月向FDA提交了BLA),它将成为首款用于预防偏头痛的IV CGRP疗法。此外,Alder还在开发一款针对垂体腺苷酸环化酶激活多肽(PACAP)的用于预防偏头痛的单抗药物ALD1910。通过收购,灵北不仅丰富了脑部疾病领域的产品管线,也增强了该领域生物药创新能力。
6.诺和诺德与美敦力达成合作。诺和诺德与美敦力达成合作,双方将携手将各自的数字产品整合到糖尿病治疗中,包括连续血糖监测设备和智能胰岛素笔之间的数据共享。美敦力的Guardian Connect是第一款智能独立动态血糖监测系统,2018年3月获FDA批准,能够帮助糖尿病患者提前预测血糖异常导致的症状。该系统每五分钟测量一次患者的血糖水平,并通过配套的手机应用显示数值,帮助患者实时监测血糖趋势并跟踪血糖浓度的变化。达成合作后,美敦力将调整更新该系统,方便整合诺和诺德智能笔传回的患者共享数据。
医药热点
1.NEJM:中国科学家利用基因编辑治疗艾滋病和白血病。中国研究人员在国际医学杂志《The New England Journal of Medicine》上发表题为《CRISPR-Edited Stem Cells in a Patient with HIV and Acute Lymphocytic Leukemia》(《利用CRISPR基因编辑的成体造血干细胞在患有艾滋病合并急性淋巴细胞白血病患者中的长期重建》)的研究论文。中国科学家在全球首次利用CRISPR/Cas9对人造血干细胞进行基因编辑,从而在动物模型中重建长期稳定的造血系统,以获得抵御艾滋病和白血病的能力。该论文的主要作者邓宏魁认为,以CRISPR为代表的基因编辑技术有望为艾滋病、镰刀型贫血等血液系统相关疾病的治疗带来新的曙光。
2.最新一批参比制剂公示。国家药监局药品审批中心发布第二十四批化学仿制药参比制剂目录公示,公示日期2019年9月16日~2019年9月27日。此次共有211个品规,涉及118个药品。其中,涉及56个注射剂品规,占比26.54%。此次第二十四批增加6个新的剂型,包括洗剂、鼻用制剂、眼膏剂,控释胶囊剂、凝胶剂、细粒剂,随着一致性评价的开展,将会有更多的剂型纳入到参比制剂目录当中。
3.我国医疗质量和安全水平显著提升。今年9月17日是首个世界患者安全日,国家卫健委召开新闻发布会介绍患者安全相关情况。近年来我国医疗质量和安全水平显著提升,住院患者死亡率、压疮发生率、输血反应率等患者安全类指标持续下降。国家卫健委医政医管局副局长周长强表示,今年,我国将患者安全日的活动口号确定为“人人参与患者安全”,旨在动员医院各个岗位的工作人员、患者及其家属、社会各界共同关注患者安全、人人参与患者安全,由点到面、形成合力,共同编织一个紧密的安全网。
【以岭药业】XY03-EA片获得临床试验通知书。
审评动向
1. CDE最新受理情况(09月17日)
2. FDA最新获批情况(北美09月16日)

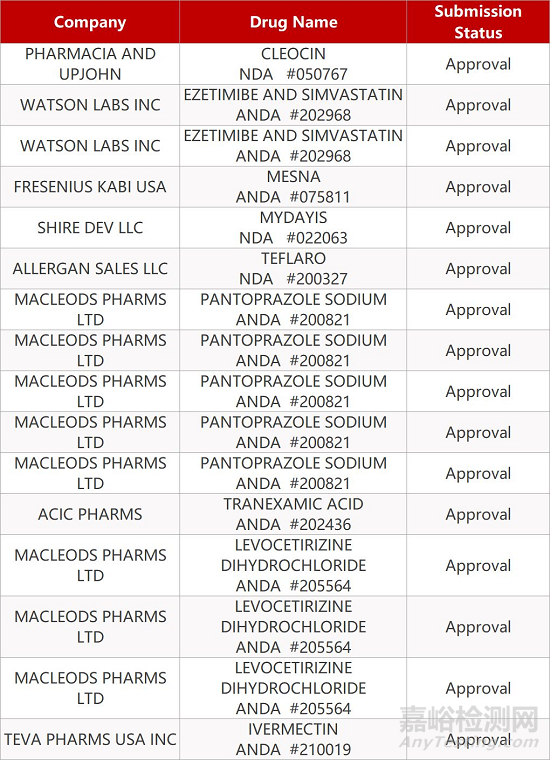

来源:药研发


