摘 要 / Abstract
近年来,mRNA修饰技术及递送技术的发展很大程度上解决了mRNA疫苗稳定性差及体内递送低效的问题。基于制造简单、研产速度快,安全性高、免疫原性好等优势,mRNA疫苗在抗击COVID-19大流行过程中发挥了重要作用。截至目前,已有多个针对新冠病毒(SARS-CoV-2)的mRNA疫苗获批上市或被授权紧急使用。此外,mRNA疫苗在其他传染病、肿瘤免疫等领域的研发及产业化也成为近期研究热点。本文总结了mRNA疫苗研发管线以及供应链方面的发展状况,期望为后续mRNA疫苗开发和产业化提供参考。
In recent years, significant progress in mRNA modification and delivery technologies has largely solved the issues of poor stability and inefficient in vivo delivery of mRNA vaccines. Leveraging advantages such as simplicity in manufacturing,rapid research and production, high safety, and strong immunogenicity, mRNA vaccines have played a pivotal role in the fight against the COVID-19 pandemic. So far, multiple mRNA vaccines against the SARS-COV-2 have been approved for marketing or authorized for emergency use. In addition, the research and industrialization of mRNA vaccines in areas such as other infectious diseases, tumor immunology have also become the focus of recent research. This paper provides an overview of the development status of mRNA vaccine research pipelines and supply chains, with the aim of offering references for the subsequent development and industrialization of mRNA vaccines.
关 键 词 / Key words
mRNA 疫苗;mRNA 疫苗研产;大规模生产;供应链;产业化
mRNA vaccine; mRNA vaccine research and production; commercial scale manufacture; supply chain; commercialization
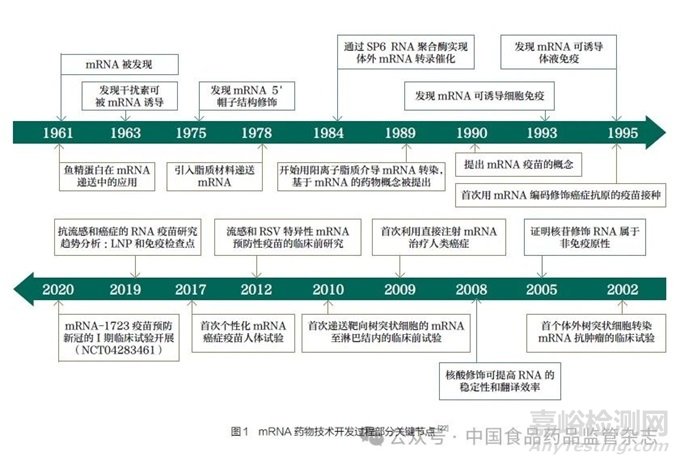
1989年,有研究者发现在脂质包裹下mRNA可以在真核细胞内转染和表达,mRNA作为药物的概念被提出[1]。1990年,研究者成功完成了体外转录mRNA在小鼠体内的表达,证明了mRNA作为药物的可行性[2]。1995年,又有研究者用小鼠模型开发了第一种编码癌胚抗原(CEA)的mRNA肿瘤疫苗,证明mRNA疫苗在肿瘤治疗领域具有较好前景[3]。然而,由于mRNA稳定性差、先天免疫原性高、体内递送效率低下,mRNA药物开发在很长一段时间内受到限制[4]。近年来,mRNA修饰技术和递送技术不断进步。2005年有研究者发现使用修饰尿苷合成的mRNA可以避免被免疫系统识别和降解,有效解决了mRNA在体内的不稳定性和高免疫原性问题;非翻译区的优化和poly(A)尾优化技术提高了mRNA的稳定性和翻译效率;纯化方法的改进有效去除了双链RNA杂质,从而减少先天免疫的非特异性激活;通过将mRNA配制成纳米颗粒,如脂质纳米颗粒(LNP)、聚合物纳米颗粒和脂质-聚合物杂化纳米颗粒,mRNA技术逐渐成为传染病和肿瘤防治领域的焦点[4-17]。2023年诺贝尔生理学或医学奖授予了科学家Katalin Karikó和Drew Weissman,以表彰他们在核苷碱基修饰方面的发现,推动了mRNA疫苗在抗击COVID-19大流行过程中发挥巨大作用;同时,mRNA疫苗也在此期间取得了快速发展[12,18-21]。mRNA药物技术开发过程中的部分关键节点见图1[22]。
1、mRNA疫苗简介
1.1 mRNA疫苗的作用机制
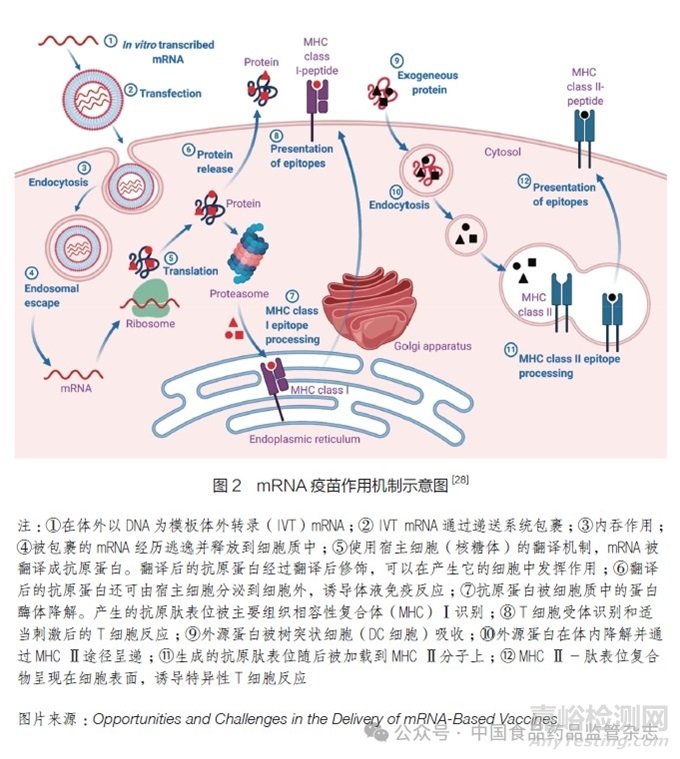
如图2所示,接种mRNA疫苗后,体外转录(IVT)mRNA通过递送载体进入靶细胞的细胞质中,通过靶细胞的表达系统合成具有特定药理活性的抗原蛋白,翻译的抗原蛋白被蛋白酶降解为抗原肽,然后被转运到内质网中,并通过主要组织相容性复合体(MHC)Ⅰ途径呈递给CD8+T细胞,以诱导细胞介导的免疫反应。部分抗原蛋白由宿主细胞分泌并被附近的抗原呈递细胞(APC)吸收,通过MHCⅡ途径呈递给抗原特异性CD4+T细胞,分泌细胞因子引发细胞免疫反应,并激活B细胞产生抗体。抗原蛋白也可以通过一种交叉呈递的机制被处理,并通过MHCⅠ途径激活抗原特异性CD8+T细胞,从而杀死肿瘤细胞或病毒感染的细胞,以达到预防和治疗疾病的目的[16,23-27]。
1.2 mRNA疫苗的结构
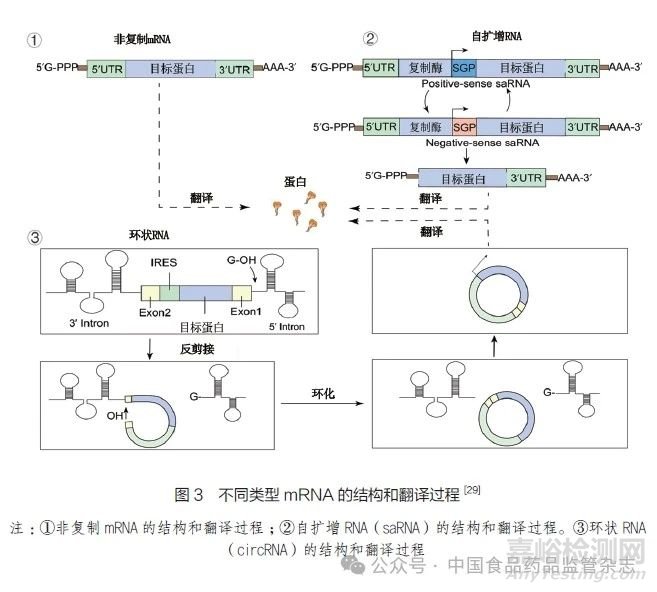
目前用于疫苗研究的mRNA主要有3种类型:非复制mRNA、自扩增RNA(sa RNA)和环状RNA(circ RNA)。其中,非复制mRNA最为常用。环状mRNA模仿了病毒感染过程,其复制机制可以大幅降低疫苗剂量;环状mRNA的闭环结构保护其免受核酸外切酶降解,稳定性更好。mRNA含有几个必要的结构,包括帽子结构(Cap)、5'非翻译区(5'UTR)、编码抗原蛋白的开放阅读框(ORF)、3'非翻译区(3'UTR)和poly(A)尾结构。自扩增mRNA疫苗的开放阅读框还包括编码细胞内RNA扩增所需的非结构蛋白,环状mRNA则是一个没有5'UTR和3'UTR的闭环结构[29]。不同类型mRNA的结构和翻译过程见图3。
如前文所述,mRNA疫苗必须被输送到人体的靶细胞才能引发免疫反应,但是mRNA进入人体后很容易被核酸酶降解,且难以透过细胞膜屏障到达细胞质,因此mRNA疫苗还需要合适的递送载体。另外,mRNA疫苗通常需要冷冻储存,需要冷冻保护剂保护递送系统不被破坏。因此,mRNA疫苗的主要组成部分包括编码抗原蛋白的mRNA,用于包埋、递送mRNA的脂质载体(最常用的是LNP),缓冲溶液(如PBS buffer或Tris buffer),冷冻保护剂(如蔗糖)。以新冠mRNA疫苗为例,辉瑞(Pfizer)与Bio NTech公司合作开发的BNT162b2以及莫德纳公司开发的mRNA-1273这两款疫苗的结构组成见图4。
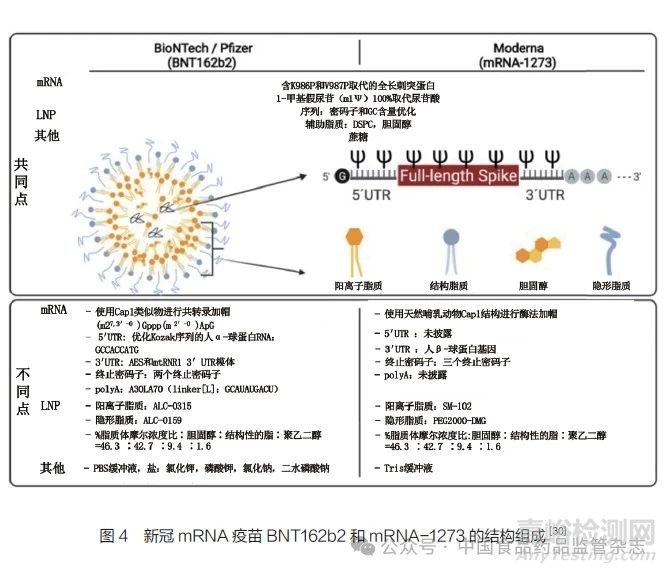
其中,mRNA制剂依靠阳离子脂质在低p H环境下有效地复合带负电荷的mRNA,形成LNP的核心[31-33]。磷脂在LNP中发挥结构作用,有助于脂质双分子层的形成和破坏,以促进内体逃逸[34-35]。胆固醇在LNP中起稳定作用,在细胞转染中至关重要[36-37]。聚乙二醇(PEG)脂质在LNP表面充当屏障,在空间上稳定LNP并减少与蛋白的非特异性结合[38]。
1.3 mRNA疫苗生产方式
基于目的mRNA的特性及临床应用,其合成方式主要有化学合成、重组生产、酶法合成等,其中体外转录(酶法)被认为是大规模生产mRNA金标准[39]。mRNA疫苗制备流程如图5所示,在上游,疫苗靶序列被导入质粒中,DNA模板被生成、扩增、纯化和线性化;在中游,使用T7RNA聚合酶在体外转录反应后合成RNA,并使用5'帽类似物共转录(或转录后加帽)实现RNA的5'加帽,再通过纯化得到高纯度的mRNA;在下游,将获得的高纯度mRNA配制在LNP中,并装入小瓶或容器中,用于大规模接种或使用[5,40-41]。
上述方法几乎适用于生产任何mRNA序列,批次间变异性低,与其他平台相比,有助于节省时间并降低经济成本。对mRNA原料药和制剂药物产品进行测试和过程分析,以评估鉴别、外观、含量、纯度、RNA完整性、残留DNA、包封率、粒径、生物活性内毒素污染和无菌性[5,43]。对于特定的mRNA,制备mRNA药物的程序可能会稍作调整,包括修饰核苷,以及采用加帽策略或纯化策略等。
生产mRNA所需的所有设备均符合良好生产规范(GMP)级别,在有限的工业规模的生产设施内,每年可生产数千万剂基于RNA的产品[5]。
1.4 mRNA疫苗优势
首先,mRNA疫苗是一种无感染、安全的平台,没有感染或插入基因组突变的潜在风险性[11,44]。其次,mRNA体内半衰期可以通过使用mRNA修饰和递送方法来调节[45]。再次,mRNA疫苗允许同时递送多种抗原,特别是对于肿瘤疫苗,可以覆盖各种肿瘤相关抗原(TAA)、肿瘤特异性抗原(TSA)或细胞因子,以引发体液和细胞介导的免疫反应,从而增强抗肿瘤功效[46]。最后,如前文所述,mRNA疫苗具有可扩展性,可以通过无细胞的体外转录(IVT)获得高产量的mRNA,且一旦建立了成熟的mRNA疫苗平台,就可以通过该平台快速开发不同的mRNA疫苗。
2、mRNA疫苗产业发展状况
2.1 mRNA疫苗研发进展
目前,大量mRNA疫苗正在研制中,部分已应用于临床治疗各种疾病,包括新冠mRNA疫苗、其他传染病mRNA疫苗和肿瘤mRNA疫苗。此外,mRNA疫苗也会与其他疗法(如化学疗法和免疫疗法)联合使用。
2.1.1 新冠mRNA疫苗
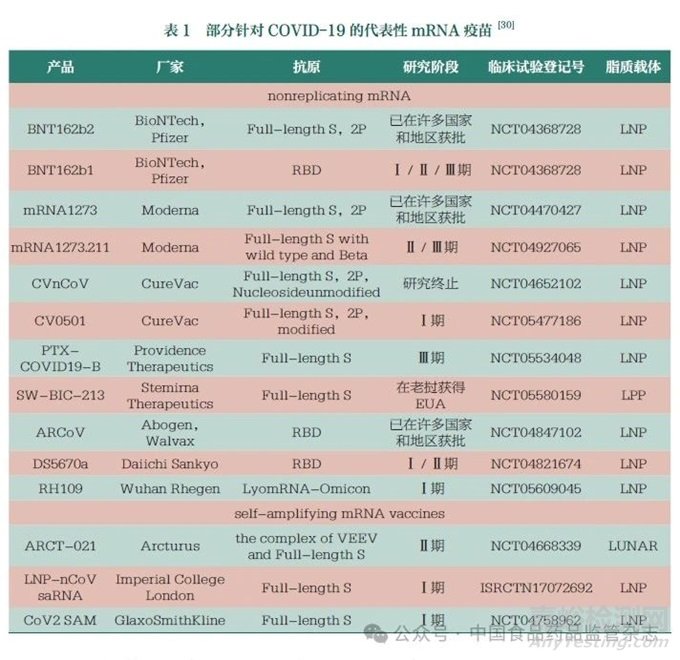
新冠病毒(SARS-Co V-2)感染引起的COVID-19大流行仍在持续,对人类健康和全球经济造成巨大影响,疫苗是抗击COVID-19大流行的主要途径。2023年1月24日世界卫生组织发布的数据显示,全球有300多种新冠候选疫苗,其中176种已进入临床试验阶段。基于mRNA疫苗在预防传染病方面的优势,新冠mRNA疫苗在COVID-19大流行期间得以快速开发及迭代,并为抗击COVID-19作出了重要贡献。辉瑞/Bio NTech公司联合开发的BNT162b2(Comirnaty)于2020年12月在美国获得紧急使用授权(EUA),其生物制品许可证申请(BLA)亦于2021年8月在美国获批,是全球第一个上市的mRNA疫苗;莫德纳(Moderna)公司的mRNA-1273(Spikevax)于2020年12月在美国获得EUA,BLA于2022年2月1日在美国获批,是全球第二个上市的mRNA疫苗;我国军事医学科学院、苏州艾博生物和云南沃森生物共同研发的AWcorna于2022年9月在印度尼西亚获得EUA,这也是我国在海外获得的第一个EUA;石药集团的SYS6006于2023年3月在我国获得EUA,为国内首款[47]。部分针对COVID-19的代表性mRNA疫苗见表1。
莫德纳公司的mRNA-1273和辉瑞/Bio NTech公司的BNT162b2均于2020年1月开始研发,并在12个月内获得EUA,目前仍在全球范围内使用,证明了mRNA疫苗预防病毒感染的有效性。临床结果表明,BNT162b2和mRNA-1273都可以诱导产生高水平的中和抗体,并引发强大的T辅助因子1细胞反应,因此在预防野生型病毒感染方面具有较好的效果(~95%)[30]。
COVID-19暴发以来,参考SARS-Co V-2序列(h Co V-19/Wuhan/WIV04/2019)观察到超过12 000个突变,大约每11天发生一次核苷酸替换[48-49]。SARS-Co V-2的特定突变引发不同的表型改变,其中一些由于可能导致病毒的传播性或毒力增强,通过自然感染或疫苗接种获得的中和抗体减少,使治疗或疫苗接种的有效性降低,被归为关注变体(VOC)[50-51]。截至目前,已经确定了5种VOC,包括Alpha、Beta、Gamma、Delta和Omicron变体[51]。莫德纳公司的mRNA-1273和辉瑞/Bio NTech公司的BNT162b2对于上述5种VOC的保护效果均出现了不同程度的下降,尤其是对于突变位点达30多个的Omicron变体的保护效果下降更为显著[52]。目前,已有多种针对SARS-Co V-2 VOC,尤其是Omicron变体的mRNA疫苗正在开发中,包括云南沃森生物与上海蓝鹊生物合作开发的RQ3013、RQ3033疫苗,并有数种已被授权使用[51-53]。
2.1.2 其他传染病mRNA疫苗
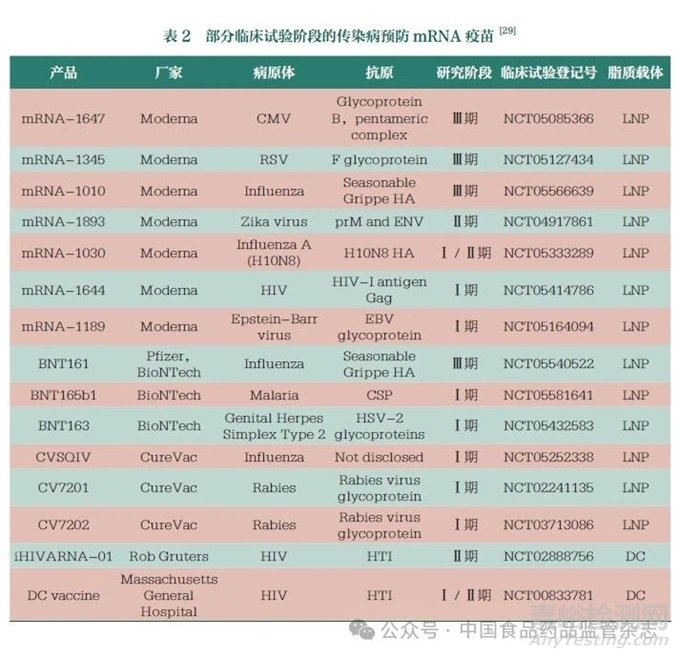
基于mRNA疫苗在传染病预防方面的优势以及在COVID-19预防中取得的效果,近年来,预防其他传染病病毒[如流感病毒、寨卡病毒、呼吸道合胞病毒(RSV)、带状疱疹病毒]的mRNA疫苗也成为研发热点,且部分已进入临床试验阶段(表2)。其中,莫德纳公司研发的针对巨细胞病毒(CMV)的mRNA-1647、针对RSV的mRNA-1345以及针对流感病毒的mRNA-1010进度较快[29]。
2.1.3 肿瘤mRNA疫苗
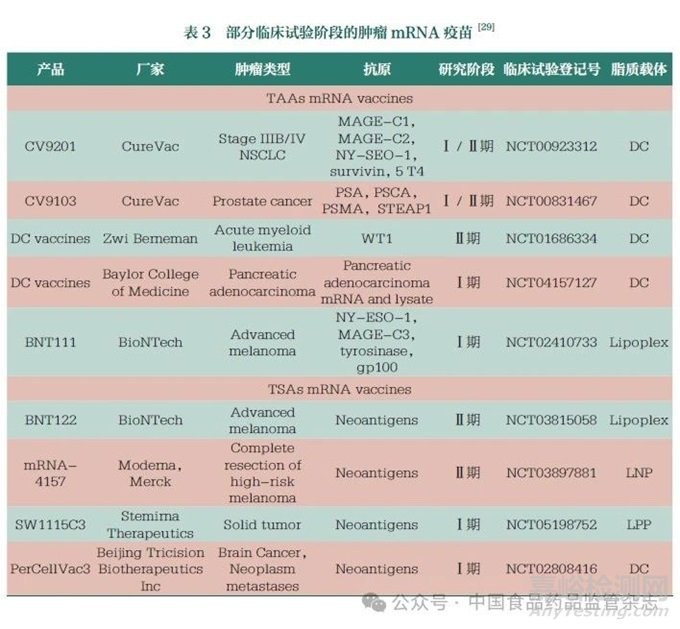
基于可编码多种肿瘤抗原、安全给药和诱导强大T细胞反应的高免疫原性等优点,mRNA疫苗已成为一种越来越受欢迎的肿瘤治疗方法。肿瘤疫苗的开发主要针对TAA和TSA。其中,TAA是由正常基因翻译而来的蛋白质,在肿瘤细胞表面异常或过度表达,但同时也存在于正常组织中,特异性较低。TSA在正常组织中不存在,但在个体肿瘤细胞中表达,具有高度特异性,因此被认为是理想的肿瘤疫苗抗原。目前,肿瘤mRNA疫苗大多仍处于Ⅰ/Ⅱ期临床试验阶段(表3)[29,54-55]。
2.2 mRNA疫苗的GMP生产
2.2.1 国内外对于mRNA疫苗GMP生产的要求及差异
我国对疫苗生产实施严格的准入制度,疫苗上市许可持有人自身应当具备疫苗生产能力,一般情况下不允许委托生产。因此,在我国预防用mRNA疫苗上市许可持有人必须自建GMP生产线,具备生产和检验放行的能力;但若不是预防用mRNA疫苗,则不受此限制,可以委托生产。国外药品监管机构对于自建生产线无具体限制要求。因此,我国mRNA疫苗企业普遍选择自建生产线;而国外相关企业更多的是基于企业自身发展战略选择自建生产线、与其他企业合作或委托生产。
预防传染病用mRNA疫苗的质粒DNA(pDNA)是否能委托生产,也是一个值得关注的问题。表3部分临床试验阶段的肿瘤mRNA疫苗[29]欧盟相关指南(Questions and Answers on the Principles of GMP for the Manufacturing of Starting Materials of Biologicalorigin Used to Transfer Genetic Material for the Manufacturing of ATMPs)把pDNA作为起始物料进行监管,允许企业委托医药合同生产组织(contract manufacture organization,CMO)生产pDNA。在我国,根据《疫苗管理法》《新型冠状病毒预防用疫苗研究阶段临床试验登记号脂质载体研发技术指导原则(试行)》等相关规定,pDNA模板定义为原液的生产工艺,企业应当自主生产pDNA[47]。
2.2.2 国内外mRNA疫苗GMP生产基地概况
疫苗生产必须通过GMP符合性检查,每个工厂都必须具备符合资质要求的人员和基础设施,因此大规模集中生产是mRNA疫苗生产现状。基于国内外疫苗监管要求的差异,国外mRNA疫苗企业主要通过与有生产能力的企业合作或委托生产,以快速扩大产能,同时启动新建生产基地,可能用于生产质粒、mRNA原液、LNP(DP)或者进行灌装和分发;而我国的大部分mRNA疫苗企业在项目早期就启动建设GMP生产基地,大多涵盖从质粒生产到最终灌装和分发的功能。
莫德纳公司和辉瑞/Bio NTech公司的新冠mRNA疫苗生产工厂几乎都分布在欧美地区。为了更好地实现疫苗的全球供应,莫德纳公司、辉瑞/Bio NTech公司与包括我国、澳大利亚、加拿大、新加坡、南非和韩国在内的几个国家或地区的企业建立了合作关系,并在部分国家和地区布局了生产基地建设计划。
mRNA疫苗企业三巨头之一Cure Vac,在德国总部拥有自己的GMP级别临床样品生产车间和产业化工厂,其产业化工厂面积达8800m2,设计年产能为3000万剂。此外,Cure Vac还与诺华(Novartis)公司合作,计划在位于奥地利的工厂生产mRNA原液和制剂,年产能可达2亿剂[53]。
云南沃森生物是国内最早布局mRNA疫苗产业化的企业,早在2021年9月就在云南省玉溪市高新区疫苗产业园建成mRNA疫苗模块化工厂,原液年产能可达10亿剂,制剂产能可达2.4亿剂。石药集团的SYS6006由其子公司巨石生物负责生产,巨石生物的mRNA生产厂房产能可达15亿剂,其中新冠mRNA疫苗10亿剂。此外,国药中生复诺健位于上海嘉定的GMP生产基地,设计最高年产能为20亿剂;云顶新耀位于浙江嘉善的GMP生产车间年产能预计可达7亿剂次;启辰生生物在珠海金湾国际健康港的GMP生产车间,建筑面积超1300m2,能实现全链条生产;还有成都威斯津位于成都天府国际生物城的在建生产基地,规划年产能1亿剂;蓝鹊生物在上海宝山规划了10 000m2 GMP生产基地;康希诺在上海临港规划了约17 000m2生产厂房[53]。
现阶段,由于新冠疫苗的需求大幅下降,mRNA生产基地的发展目标由快速扩大产能转变为与mRNA疫苗企业自身战略相适应。基于mRNA疫苗高度平台化的特点,这些生产基地可以迅速用于其他mRNA疫苗的开发。
3、mRNA疫苗供应链概况
3.1 国内外mRNA疫苗供应链概况
随着新冠mRNA疫苗的发展,基于传统生物药物的供应链,mRNA疫苗供应链也愈发成熟。mRNA疫苗供应链主要包括主要设备、原材料及关键耗材,其中比较关键的是酶、核苷酸底物、帽子结构类似物、脂质辅料、分离纯化设备与耗材、LNP包封设备与质控设备等。
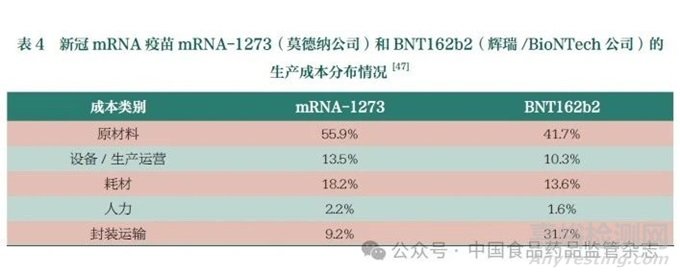
已上市的新冠mRNA疫苗中,莫德纳公司的mRNA-1273和辉瑞/Bio NTech公司的BNT162b2的原材料成本占比分别为55.9%和41.7%(表4),可见原材料在mRNA疫苗生产中的重要性。其中,帽子结构类似物(46%)、酶类(约30%)占据了大部分原材料成本(表5)[47]。
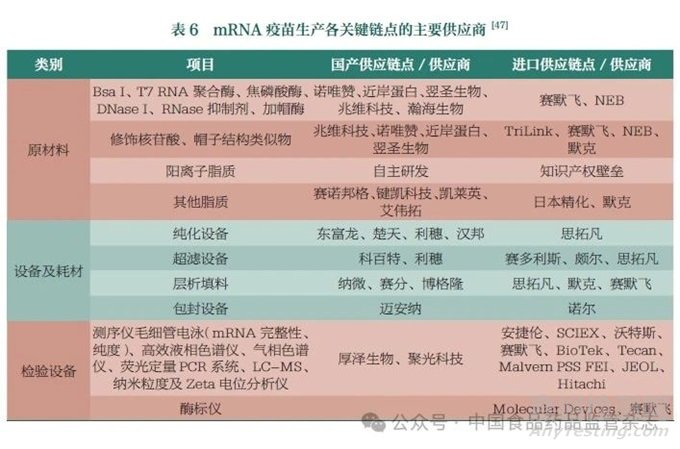
mRNA疫苗生产各关键链点的主要供应商详见表6。从表中可以看出,mRNA疫苗生产所需原材料和设备等已基本实现国产替代,进步巨大。部分原辅料和耗材由于生产工艺和质量的局限性和稳定性,目前仍难以实现国产替代。尤其是mRNA合成纯化及后续制剂工艺中的关键耗材,由于色谱填料和中空纤维柱等生产用高值耗材研发周期较长,且涉及材料学、流体动力学、工程力学及精细化工等多学科交叉,尚存在国产化水平较低、产品质量有待提高等情况;基于对检测仪器的高精度要求,大部分检验仪器仍依赖进口。另外,递送系统、核苷酸修饰、帽子结构类似物、LNP制备设备还存在一些专利问题。因此,为了实现国产mRNA疫苗的国际化,开发具有自主知识产权的国产物料将成为未来我国mRNA疫苗产业化的重点之一。
许多国内mRNA疫苗研发企业出于降低供应链风险的考虑,正积极开展关键原材料的国产化替代研究工作,如对限制性内切酶(BsaⅠ)、DNA核酸酶(DNaseⅠ)开展了全面的质量标准和工艺对比研究。结果表明,国产物料质量标准在一定程度上比进口物料的质量标准更加完善;对于同一物料,国产供应商和进口供应商来源对产品质量的影响无明显差异。
目前,从mRNA疫苗物料供应商调研和审计情况来看,大部分原辅料均可实现国产替代。极少部分原辅料的纯度对于LNP结构稳定非常重要,国产物料纯度尚不能满足产品工艺质量需求,仍然采用进口物料。
4、总结与展望
mRNA疫苗因具有灵活、安全、可调控以及快速开发等特点,成为生物制药领域的一颗冉冉升起的新星。其不仅在抗击COVID-19大流行中发挥了巨大作用,也将在肿瘤免疫和传染病领域成为应用热点。相关研产管线及供应链也将更加成熟,同时已建成或在建的平台化mRNA疫苗研产管线将推动mRNA疫苗产业高速发展。此外,个体化医疗也有望成为mRNA疫苗研产管线布局的重要方向之一。但需要关注的是,目前mRNA疫苗生产成本尤其是原材料成本仍较高,降低原材料成本可大大提高疫苗的产品可及性。开发自扩增RNA(sa RNA)疫苗以降低mRNA疫苗的剂量要求可能是前景较好的方法之一,另外也有报道采用类似重组蛋白的方式基于细菌/细胞系统生产mRNA,从而在保证mRNA疫苗质量的同时有效降低生产成本。目前,mRNA疫苗的专利壁垒仍较多,为了实现国产mRNA疫苗的国际化,具有自主知识产权的国产物料的开发力度需要进一步加强。
引用本文
刘财旺,龙新华,包嫄,李薇*.mRNA疫苗技术和产业发展概况[J].中国食品药品监管,2023(12):74-84.