近来,随着世界人口老龄化的加剧,心血管疾病已超过癌症成为威胁人类健康的头号杀手,预计到 2030 年,全球将有 2330 万人死于心血管疾病。支架植入术已逐渐取代传统的开胸手术,成为治疗冠状动脉疾病(CAD)最有效的方法。支架植入后,支架的暴露不可避免地会损伤动脉组织,引发一系列病理过程,包括血栓形成和急性炎症反应。这些过程相互关联,导致细胞外基质(ECM)过度沉积和平滑肌细胞(SMC)增殖,最终引起内膜增生(支架内再狭窄(ISR)的主要原因)。药物洗脱支架(DES)可通过局部释放抗增生药物(如雷帕霉素、西罗莫司、氨曲南司和依维莫司)有效降低ISR的发生率。然而,迄今为止,内皮单层延迟愈合一直被认为是晚期支架血栓形成(LST)的主要风险因素,从而限制了 DES 的长期疗效。因此,寻找开发既能避免 LST 又能促进血管新生层愈合以对抗抗增生药物的无药支架的可能性仍具有重要意义。考虑到复杂的材料/血液相互作用,开发具有多功能表面的支架(无论可降解或不可降解),使血管支架具有抗凝、抗炎和选择性增强内皮化功能,从而调节血管新内膜重塑并促进损伤组织再生,是一种很有前景的方法。
来自四川大学的王云兵团队开发了一种无药涂层配方,该配方具有定制的重组人源化 III 型胶原蛋白功能,能在支架植入后对损伤组织产生一举多得的效果。本研究证明了这种“一产多”涂层具有抗凝、抗炎和抑制内膜增生的特性。本研究进行的转录组分析表明,无药涂层有利于内皮化过程,并诱导平滑肌细胞向收缩表型转化。本研究发现,与药物洗脱支架相比,我们的无药支架能减少兔子和猪模型中支架内再狭窄的发生,并能改善兔子模型中血管新内膜的愈合。总之,“一产多”无药物系统是下一代支架的一个有前途的策略。相关工作以题为“A drug-free cardiovascular stent functionalized with tailored collagen supports in-situ healing of vascular tissues”的文章发表在2024年01月25日的国际顶级期刊《Nature Communications》。
1. 创新型研究内容
本研究报告了使用定制的重组人源化 III 型胶原蛋白(rhCol III)设计的一种一产多的无药物涂层配方,以调节血管重塑,有望解决药物洗脱支架的 ISR 和不完全内皮化等难题(图 1)。通过多巴胺和聚乙烯亚胺共聚制备的富胺表面有效连接了定制的 rhCol III。利用模拟血流系统研究了一产多涂层的稳定性。体外和体内试验表明,单组分 rhCol III 涂层可以通过介导巨噬细胞向 M2 表型转化、加速内皮化进程、抑制 SMC 从合成表型向收缩表型转化来抑制炎症反应,从而在小动物模型和大动物模型中减少 ISR 并促进支架的长期通畅。综合上述结果,这种一举多得的策略(无药涂层)在血管新内膜愈合方面展现出巨大潜力,有望成为下一代血管支架的发展方向。
图1 为心血管植入物/介入装置制备具有抗凝、消炎和增强内皮化特性的 "一产多 "涂层的功能模型、可能存在的相互作用和制备过程
【(rhCol III/PDA-PEI)n 涂层的构建与表征】
(rhCol III/PDA-PEI)n 的无药配方如图 1 所示。简而言之,首先用多巴胺和聚乙烯亚胺(PEI)处理聚(l-乳酸)(PLA)基底(包括片材和支架),生成经典的贻贝模拟富胺表面(PEI-PDA),以便进一步改性。然后,在 1-乙基-3(3-二甲基氨基丙基)碳二亚胺(EDC)和 N-羟基琥珀酰亚胺(NHS)的作用下,通过共价键和静电作用将 rhCol III 牢固固定在 PEI-PDA 表面,形成(rhCol III/PDA-PEI)n 。通过 FITC 标记的 rhCol III 的荧光信号可以直接观察到 rhCol III 在 PDA-PEI 涂层上的固定情况。如图 2a所示,对照组裸聚乳酸和 PDA-PEI 组未观察到荧光信号,而随着 rhCol III 浓度的增加,在聚乳酸片上制备的(rhCol III/PDA-PEI)n (n = 0.5、1、2 和 4)涂层的荧光信号增强。结果表明,rhCol III 成功固定在了 PDA-PEI 涂层上。然后,用扫描电镜观察了在聚乳酸基底(包括片材和支架)上制备的(rhCol III/PDA-PEI)n 涂层(n = 0.5、1、2、4)的表面微观形态。聚乳酸表面相对光滑,而 PDA-PEI 涂层表面较粗糙,有少量聚集的纳米颗粒,这些颗粒是由多巴胺(DA)自聚合到 PDA 中,并通过迈克尔加成和希夫碱反应与 PEI 同时反应形成的。随着 rhCol III 浓度的增加,在(rhCol III/PDA-PEI)n 上观察到的颗粒数量逐渐增加,颗粒看起来更加均匀和平均分布。随着 rhCol III 浓度从 0.5 毫克/毫升增加到 4 毫克/毫升,(rhCol III/PDA-PEI)n 涂层的厚度从 25.1 纳米增加到 29.2 纳米(图 2b)。(rhCol III/PDA-PEI)n 组之间的差异不明显,这表明涂层并没有持续垂直生长,而是分布得更加均匀,这与扫描电镜结果一致。经过 PDA-PEI 涂层改性后,由于引入了丰度的胺基团,聚乳酸基底的亲水性显著提高,水接触角(WCA)从 92.3°下降到 24.1°。随着 rhCol III 浓度的增加,(rhCol III/PDA-PEI)n 的亲水性逐渐降低(WCA 从 33.3°到 55.9°)(图 2c)。WCA 结果进一步证实了上述结论。上述结果证实,较高浓度的 rhCol III 能使 (rhCol III/PDA-PEI)n 涂层具有较高的覆盖率。
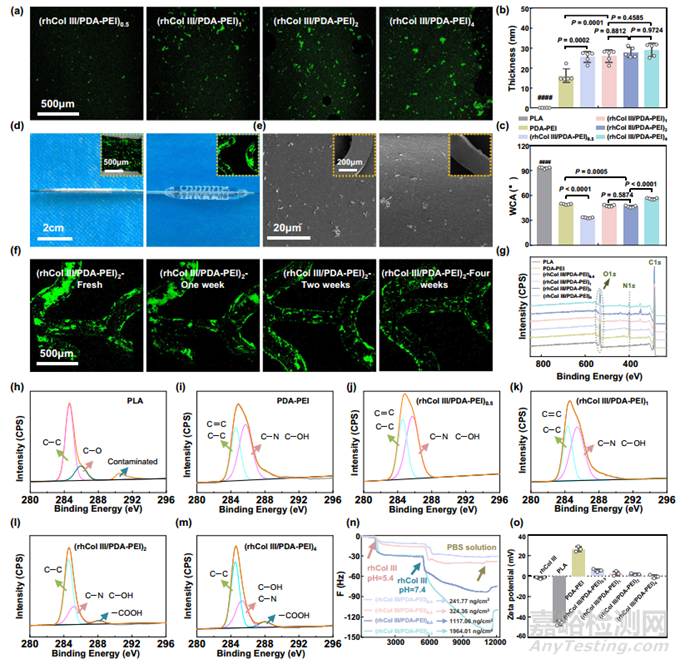
图2 开发用于血管支架的(rhCol III/PDA-PEI)n 无药涂层
为了进一步评估改性聚乳酸支架涂层的机械稳定性,本研究首先用血管成形球囊在 37℃磷酸盐缓冲盐水(PBS,pH 7.4)溶液中进行了扩张试验。支架扩张后,(rhCol III/PDA-PEI)2 涂层(用 FITC 标记的 rhCol III 制备)的荧光信号没有明显衰减(图 2d)。不出所料,(rhCol III/PDA-PEI)n 涂层保持完好(图 2e),可见颗粒在扩张后没有明显差异。然后,将扩张后的(rhCol III/PDA-PEI)n 改性支架(n = 0.5、1、2 和 4)置于 37 ℃ 牛血清流动系统中,模拟复杂多变的生理环境。循环 4 周后,与相应的新鲜涂层相比,脱落的颗粒相对较少其中,(rhCol III/PDA-PEI)2和(rhCol III/PDA-PEI)4都保持了均匀、连续的 rhCol III 覆盖。因此,本研究选择(rhCol III/PDA-PEI)2 作为初始尝试样品,以评估涂层的稳定性。与新鲜的(rhCol III/PDA-PEI)2涂层相比(对照组,荧光信号为100%),(rhCol III/PDA-PEI)2涂层的荧光信号在循环1周、2周和4周后分别相应减弱至初始荧光信号强度的89.13%、75.64%和60.15%(图2f和补充图6),这意味着涂层在植入后相对稳定。
【无药物(rhCol III/PDA-PEI)n 涂层可改善血液相容性】
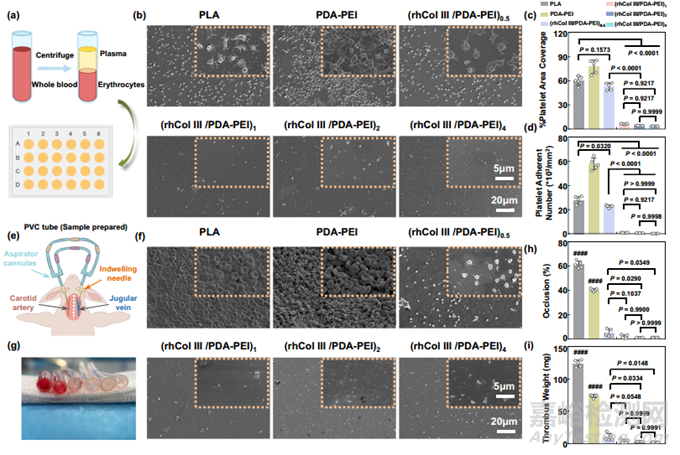
由于生物医学设备在植入后会接触血液,因此对其抗血栓性能进行体外和体内评估至关重要。样本表面血小板的聚集和活化与支架内再狭窄和 LST 密切相关。未涂层、PDA-PEI 涂层和(rhCol III/PDA-PEI)n 涂层聚乳酸的抗凝能力是通过血小板粘附试验在体外进行评估的(图 3a)。培养 2 小时后,严重的血小板粘附在裸聚乳酸和 PDA-PEI 涂层表面,呈完全展开状或典型的伪足状,表明血小板高度活化。血小板在(rhCol III/PDA-PEI)n 涂层表面的粘附明显减少,并呈现球形,抗凝效果极佳;这种效果与 rhCol III 绕过羟脯氨酸(O)序列有关,而羟脯氨酸可能会诱导血小板粘附和活化(图 3b)。定量分析也证实,(rhCol III/PDA-PEI)n 组(浓度分别为 0.5、1、2 和 4)能显著抑制血小板的粘附和活化(图 3c、d)。值得注意的是,当浓度大于 2 时,(rhCol III/PDA-PEI)n 组表面的覆盖面积和粘附血小板的数量急剧下降,这表明足够的 rhCol III 含量对抑制血小板非常重要。
图3 (rhCol III/PDA-PEI)n 涂层(n = 0.5、1、2 和 4)改善血液相容性
【无药物(rhCol III/PDA-PEI)n 涂层可调节 HUVEC 的生长行为】
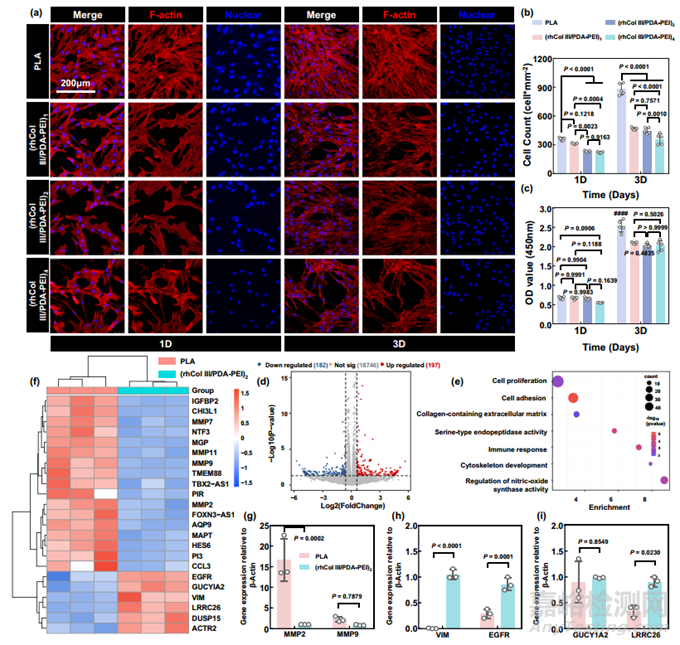
在血管支架植入过程中,血管壁不可避免地会受到损伤。这种行为会引发一系列病理反应,包括血栓形成、炎症反应、平滑肌细胞(SMC)过度迁移和增殖,从而导致支架内再狭窄(ISR)。致密健康的内皮层可有效提高内皮的抗血栓能力,并在血管壁重塑过程中发挥积极作用。根据罗丹明共轭类黄素(TRITC-Phalloidin)的检测结果,与裸聚乳酸基底相比,负载了不同数量 rhCol III 的涂层(rhCol III/PDA-PEI)n (n = 1、2、4)都能更好地覆盖 HUVEC、4′,6-二脒基-2-苯基吲哚(DAPI)染色和二醋酸荧光素(FDA)染色的结果显示,在培养 1、3、5 和 7 天后,rhCol III 均能更好地覆盖 HUVEC,表明其与 HUVEC 具有良好的相容性(图 4a)。值得注意的是,粘附在(rhCol III/PDA-PEI)n (n = 1、2、4)表面的 HUVEC 在培养 7 天后形成汇合单层,而粘附在聚乳酸表面的 HUVEC 则没有形成汇合单层。出现上述现象的原因是 rhCol III 保留了人源化 III 型胶原的高粘附性片段 GER 和 GEK。如图 4b 和 c 所示,在指定时间点,(rhCol III/PDA-PEI)n 涂层表面的 HUVEC 数量高于对照组表面的 HUVEC 数量。正如详细说明的那样,PLA 组的 HUVEC 只是在早期表现出较高的生长率(1 天后为 80 个细胞/平方毫米,3 天后为 166 个细胞/平方毫米),而(rhCol III/PDA-PEI)n 组在促进细胞生长方面始终表现出优势(例如,(rhCol III/PDA-PEI)2,5 天后为 659 个细胞/平方毫米,7 天后为 1165 个细胞/平方毫米)。最令人印象深刻的是,与其他样品相比,(rhCol III/PDA-PEI)2 样品在指定时间点的细胞存活率最高;然而,随着 rhCol III 浓度从 2 毫克/毫升增加到 4 毫克/毫升,(rhCol III/PDA-PEI)4 组的细胞存活率并没有持续上升。这种与剂量无关的模式可能是因为(rhCol III/PDA-PEI)4 涂层的表面电位近似于 0 mV,且随着 rhCol III 负载的增加而趋近于 0 mV,这与齐聚物表面行为相似,从而阻碍了细胞的粘附。
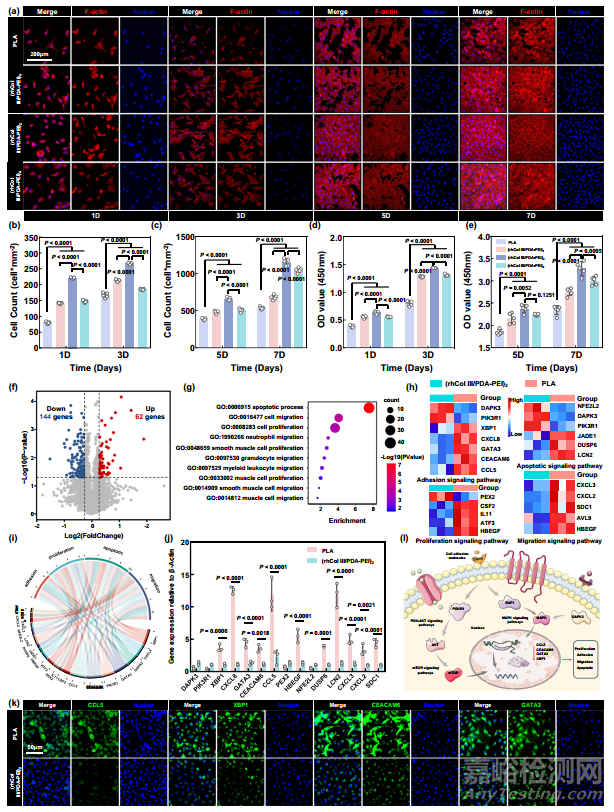
图4 (rhCol III/PDA-PEI)n 涂层(n = 0.5、1、2 和 4)调节 HUVEC 的行为
【无药物(rhCol III/PDA-PEI)n 涂层诱导 HUASMCs 向收缩表型转化】
在植入早期抑制 HUASMC 过度增殖可有效防止后期血栓形成、后期再狭窄和材料失效。本研究通过 TRITC-phalloidin 和 DAPI 荧光图像研究了 HUASMC 的附着和形态。与 PLA 组相比,(rhCol III/PDA-PEI)n (n = 1、2 和 4)涂层在培养 1、3、5 和 7 天后均不同程度地抑制了 HUASMC 的粘附和增殖(图 5a)。很明显,各组表面附着的 HUASMC 数量都有所增加,尤其是 PLA 组随着培养时间从 1 天延长到 5 天,细胞增长率最高(如 360-1123 个细胞/mm2)、PLA组为360-1123个细胞/mm2,(rhCol III/PDA-PEI)1组为313-434个细胞/mm2,(rhCol III/PDA-PEI)2组为233-380个细胞/ mm2,(rhCol III/PDA-PEI)4组为220-436个细胞/ mm2)。然而,随着培养时间延长至 7 天,各组表面粘附的 HUASMC 数量并没有持续增加,而是逐渐减少,显示出细胞凋亡的迹象(图 5b)。CCK-8 检测的结果也证实,在指定的时间点,PLA 组的细胞增殖比(rhCol III/PDA-PEI)n 组明显增强(图 5c)。特别是,(rhCol III/PDA-PEI)n (n = 1、2 和 4)涂层对 HUASMC 增殖的抑制程度几乎没有变化。这一现象可能是由于随着 rhCol III 负载的增加,涂层的表面电位逐渐接近 0 mV,正如在 HUVECs 中观察到的一样。(rhCol III/PDA-PEI)n (n = 1、2 和 4)涂层在 HUVECs 和 HUASMCs 上的不同生长趋势可能是由于材料表面/界面与细胞之间相互作用的敏感性和反应性不同造成的。
图5 (rhCol III/PDA-PEI)n 涂层(n = 0.5、1、2 和 4)通过介导表型转换抑制 HUASMC 的粘附和增殖
【无药物(rhCol III/PDA-PEI)n 涂层可抑制体外炎症反应】
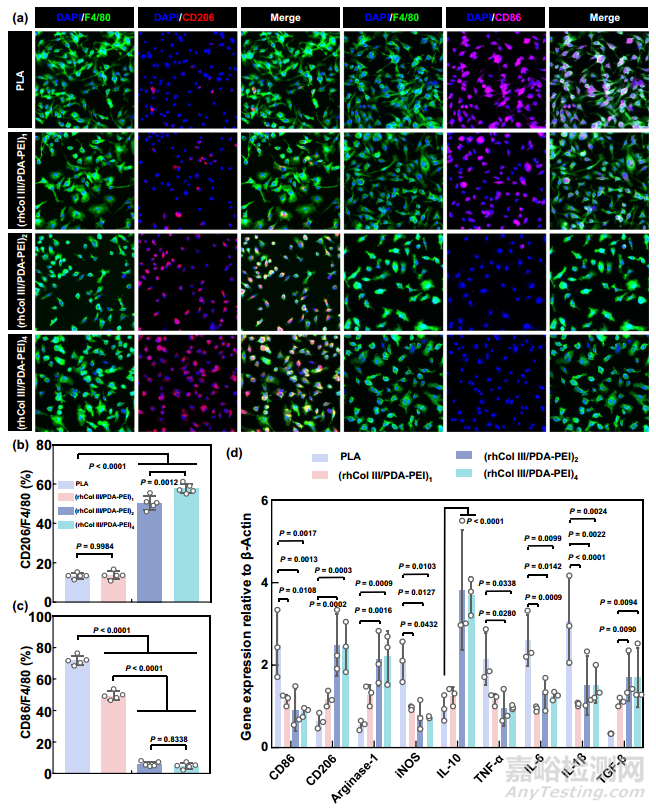
为了研究定制的 rhCol III 的抗炎功能,本研究首先进行了 TRITC-phalloidin 和 DAPI 荧光染色。原代小鼠骨髓单核细胞(MBMMCs)粘附在聚乳酸和(rhCol III/PDA-PEI)1 的表面,并呈现出拉长和拉伸的形状。然而,随着 rhCol III 负载的增加,在(rhCol III/PDA-PEI)2 和(rhCol III/PDA-PEI)4 组中观察到更多的圆形 MBMMC。正如先前所报道的,巨噬细胞的形态与极化密切相关。因此,本研究通过免疫荧光染色进一步研究了 MBMMCs 的极化,标记物 F4/80、CD86 和 CD206 分别表征巨噬细胞的 M1 和 M2 表型。与 PLA 组和(rhCol III/PDA-PEI)1 组相比,(rhCol III/PDA-PEI)n 组(n = 2 和 4)CD86 的表达明显下调,而 CD206 的表达明显上调(图 6a)。特别是,聚乳酸的降解产物和(rhCol III/PDA-PEI)1 表面暴露的胺(rhCol III 未完全覆盖)都会导致强烈的炎症反应。相应地,定量统计结果也显示,与 PLA 对照组和(rhCol III/PDA-PEI)1 组相比,(rhCol III/PDA-PEI)n 组(n = 2 和 4)的 M1 巨噬细胞比例下降,M2 巨噬细胞比例上升(图 6b,c)。同时,通过 PCR 阵列测定了一系列代表性细胞因子(即抗炎细胞因子 CD206、精氨酸酶-1、IL-10 和 TGF-β,以及促炎细胞因子 CD86、iNOS、TNF-α、IL-6 和 IL-1β)的基因表达,以证明巨噬细胞表型的差异是由(rhCol III/PDA-PEI)n 涂层介导的。正如预期的那样,这些因子的表达与 CD86/CD206 免疫荧光结果有很好的相关性,在(rhCol III/PDA-PEI)n (n = 2 和 4)组中,促炎基因的表达显著下调,而抗炎基因的表达显著增加(图 6d)。
图6 (rhCol III/PDA-PEI)n 涂层(n = 0.5、1、2 和 4)可减轻炎症反应并调节 MBMMC 的表型
【无药物(rhCol III/PDA-PEI)n 涂层在大鼠模型中的组织相容性】
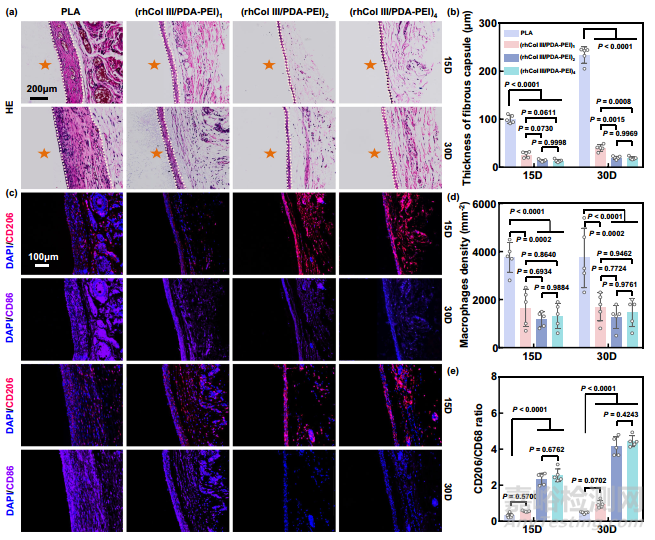
皮下植入是研究植入物/组织界面周围炎症反应的通用模型。将(rhCol III/PDA-PEI)n (n = 1、2 和 4)涂层皮下植入雄性 Sprague-Dawley 大鼠体内后,本研究对其体内抗炎能力进行了进一步分析。分别在植入 15 天和 30 天后收获样品周围的纤维囊。纤维包囊的厚度和浸润的炎症细胞(主要包括巨噬细胞和淋巴细胞)的数量反映了植入物的炎症反应。一般来说,炎症细胞浸润会增加,纤维包膜越厚表明组织反应越严重。根据 HE 和 Masson 三色染色结果,本研究发现在指定时间点,聚乳酸片周围形成的纤维囊明显比(rhCol III/PDA-PEI)n 组(n = 1、2、4)厚(图 7a、b)。此外,本研究还进行了 CD86/CD206 免疫荧光染色。结果显示,与 PLA 组相比,(rhCol III/PDA-PEI)n 改性组在第 15 天和第 30 天的巨噬细胞数量减少,M2 型巨噬细胞比例(CD206/CD68 比值)增加,尤其是在 (rhCol III/PDA-PEI)2 组和 (rhCol III/PDA-PEI)4 组(图 7c,d)。与巨噬细胞的观察结果一致,PLA 组淋巴细胞浸润的数量最多,(rhCol III/PDA-PEI)n 组淋巴细胞浸润的数量很少。与巨噬细胞的大量浸润形成鲜明对比的是,淋巴细胞的数量相对较少,这意味着植入物引发的炎症反应主要是由巨噬细胞介导的。总之,体内抗炎结果与体外结果一致,本研究进一步证实了(rhCol III/PDA-PEI)n (n = 2 和 4)涂层能有效降低聚乳酸基底的体内炎症反应,显示出良好的组织相容性。
图7 体内((rhCol III/PDA-PEI)n 涂层(n = 0.5、1、2 和 4)可减轻大鼠模型的炎症反应
【在兔子和猪模型中植入支架】
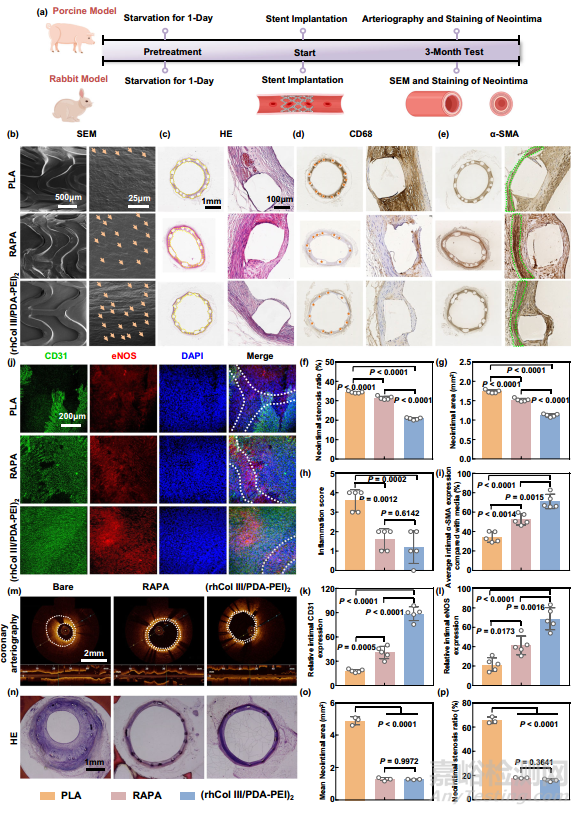
为了进一步评估本研究开发的(rhCol III/PDA-PEI)n 涂层能否在抑制内膜增生的同时有效促进原位内皮化,本研究在兔子和猪模型中进行了长期支架试验(图 8a)。在兔子的腹主动脉中植入 3 个月后,收获由裸聚乳酸、雷帕霉素洗脱修饰(RAPA)和(rhCol III/PDA-PEI)2 聚乳酸制成并被新生内膜包围的支架。如 SEM 图像(图 8b)所示,聚乳酸支架完全被新生内膜覆盖,新生内膜内表面的细胞形态呈随机分布。RAPA组和(rhCol III/PDA-PEI)2修饰的聚乳酸支架都被一层规则排列的细胞完全覆盖,与RAPA组相比,(rhCol III/PDA-PEI)2包裹的聚乳酸支架表面的细胞更多。细胞在聚乳酸表面呈现不规则状态,表明新生内膜表面由不同的细胞和分泌的细胞外基质组成,而 RAPA 和(rhCol III/PDA-PEI)2 包被的聚乳酸支架表面的细胞呈鹅卵石状,是典型的内皮细胞。值得注意的是,与 RAPA 组相比,(rhCol III/PDA-PEI)2 组粘附的细胞更密集,并伴有更成熟的表型,形态细长,定向性强。HE 染色和免疫组化染色验证了管腔狭窄率、炎症反应和新生内膜的 SMC 表型(图 8c-e)。与 RAPA 和(rhCol III/PDA-PEI)2 支架相比,裸聚乳酸支架周围形成的新生内膜更厚(图 8c)。此外,定量分析表明,聚乳酸支架的直径几乎相同,与参考值(2.75 毫米)非常吻合。在所有组别中,裸聚乳酸支架的内膜增生最为严重,表现为较高的管腔狭窄率(34.4 ± 0.51%)和新生内膜面积(1.73 ± 0.041 mm2)。与 RAPA 组相比,(rhCol III/PDA-PEI)2 组的再狭窄率和新生内膜面积分别从 31.5 ± 0.9% 降至 20.8 ± 0.56%,从 1.52 ± 0.040 mm2 降至 1.12 ± 0.037 mm2,表明其抑制内膜增生的能力更强(图 8f、g)。
图8 在兔子和猪模型中植入支架
2. 总结与展望
总之,在家兔模型中,(rhCol III/PDA-PEI)2 涂层通过促进 M2 巨噬细胞极化、加速内皮化进程和抑制 SMC 从合成表型向分泌表型转变,减少了炎症反应,从而减少了血管狭窄,促进了支架区域的长期通畅性。因此,(rhCol III/PDA-PEI)2 涂层展示了一种潜在的表面改性策略,可实现理想的血管新内膜愈合。令人惊讶的是,在猪的动物模型中,从整个支架动脉段的角度来看,无药物(rhCol III/PDA-PEI)2支架表面形成的新生内膜比市面上销售的RAPA支架上形成的新生内膜更薄,这进一步提高了开发新一代无药物支架的临床兴趣。
文章来源:https://doi.org/10.1038/s41467-024-44902-2