我国创新医疗器械特别审查程序已于2018年发布,然而仍有不少制造商对创新医疗器械申报一知半解。本期通过5个常见共性问题的答疑,便于各位快速全面高效掌握相关知识点。
问 题 1:创新医疗器械申报,从哪来?
答:2014年起,依托新技术的医疗器械纷纷涌现,为广大患者带来医疗获益;为鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展,国家药监局于2015年发布《国务院关于改革药品医疗器械审评审批制度的意见》;2017年发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,同年发布《创新医疗器械特别审查程序》;2018年接连发布《创新医疗器械特别审查程序》的修订稿及编写指南,为创新医疗器械的发展提供坚实的保障。
问 题 2:申请创新医疗器械,需满足哪些条件?
答:申请创新医疗器械的产品必须同时具备以下三项条件:
☑ 注册申请人需拥有中国发明专利权或其使用权,而且该专利的授权不超过5年;或者注册申请人所申请的发明专利已公开处于专利审查阶段,国家知识产权局出具专利查新报告,说明该专利具有创新性;
☑ 该医疗器械的研发已经完成,产品的安全有效性已经得到一定程度的确认;
☑ 该医疗器械属于国内首创,并具有显著的临床应用价值。
问 题 3: 创新医疗器械审评,需提交哪些资料?
答:首先,需注意区分的是:三类创新医疗器械由国家局进行审评;二类创新医疗器械由各个省局进行评审。
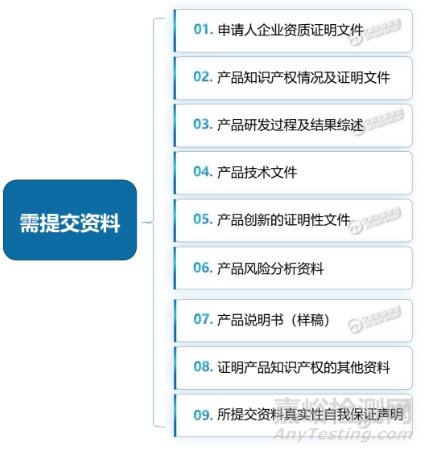
其次,申请需填写《创新医疗器械特别审查申请表》,并应提交以下一系列资料(见图)↓
此外,境外申请人还需提交:委托人或境内代理人委托书,代理人或申请人在中国境内办事机构的承诺书及代理人营业执照,或申请人在中国境内办事机构的机构登记证明。
问 题 4:取得创新医疗器械批件, 产品是否就能销售了?
答:不是。获得创新医疗器械批件仅代表:审评部门已认可该医疗器械具有创新性,在注册申报过程中会由专人负责沟通辅导,可享受优先审评,加快获得注册证的速度,并非“不需要开展注册申报”。
问 题 5:创新医疗器械申请,对企业有什么好处?
答:如果获得创新医疗器械批件,国家药监部门会有专人负责辅导该产品的注册审评过程,可以少走不少申报中的弯路,另外审评过程中可享受到优先审评、优先体考、优先审批。
此外,如果最终顺利拿下医疗器械注册证书,让公司与品牌的声誉和企业融资估值都受益良多。