随着AI技术的不断发展,越来越多的AI产品被应用于医疗领域,在生物技术、医学影像识别、药物研发、辅助诊断等领域发挥了重要作用。医疗AI技术可在4个方面有效改善医疗服务:一是通过减少成本和资源浪费以及提高工作效率,来提高生产力;二是通过提高诊断的准确性和减少患者就医等待时间等,来提高服务质量;三是通过AI技术制定个性化医疗方案,使医疗方式更加准确;四是AI技术参与新药的开发,使药物治疗更加有效。
我国医疗AI技术管理现状
2017年,国家药品监督管理局成立人工智能工作组,开展了人工智能医疗器械监管研究,主要包括AI医疗器械测评数据库建立、算法评估、数据安全等,并重视产学研医检相结合和跨学科合作。2019年,国家药品监督管理局联合国家相关部委、科研机构、医疗机构等,共同成立人工智能医疗器械创新合作平台,设立了技术法规、数据治理、网络安全等10个工作组,通过合作平台推动各工作组开展多层面、多角度科学研究。2020年,国家标准化管理委员会、中央网信办、国家发展改革委、科技部、工信部联合发布《国家新一代人工智能标准体系建设指南》(国标委联【2020】35号),计划在医疗等领域初步建立智能AI标准体系,围绕医疗数据、医疗诊断、医疗服务、医疗监管等,重点规范医疗AI技术在数据获取、数据隐身管理等方面的应用,制定了包括医疗数据特征表示、AI医疗质量评估等标准。2021年,国家医保局、国家卫生健康委、国家发展改革委等八部委联合发布《深化医疗服务价格改革试点方案》(医保发【2021】41号),提出要优化新增价格项目管理,简化新增价格项目申报流程,重点关注新增价格项目的创新性及经济性,加快受理审核进度,促进医疗技术创新发展和临床应用。
国外医疗AI技术管理概况
英国医疗AI技术管理概况
在英国,直接用于医疗目的的人工智能系统被纳入医疗器械、体外诊断设备或可移动植入设备的管理范畴,一般不对含有AI技术的医疗设备进行单独管理。2022年6月,英国药品和健康产品管理局针对英国脱欧后医疗器械和体外诊断医疗器械未来监管法规的立法协商发布政府回复,不建议单独为作为医疗设备的AI技术(Artificial Intelligence as a Medical Device,AIaMD)进行定义,也不会为AIaMD设定额外的法规要求,只将之视为一般的医疗设备软件进行管理。
美国医疗AI技术管理概况
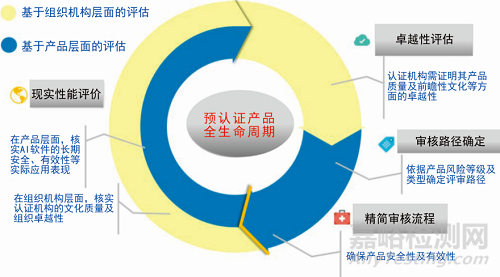
随着越来越多的智能软件被开发成健康产品,美国食品药品监督管理局认为传统的评审方法已经不适用监管医疗软件。FDA于2017年7月启动医疗器械独立软件预认证试点项目,并分别于2018年4月、2018年6月、2019年1月发布3个更新版本,旨在通过考查此类产品的特征、临床前景、独特的用户界面以及行业内引进此类产品的商业周期等,建立专门针对电子健康产品的监管方法。
欧盟医疗AI技术管理概况
欧盟白皮书提出将AI技术分为高风险和非高风险两类进行监管。对于高风险的人工智能,需要先进行客观的合格性评估,以验证并确保AI技术能够达到高风险应用程序的特定要求。2019年4月,欧盟委员会发布《可信赖人工智能道德准则》的正式生效文本,提出AI系统要达到可信赖要求必须满足以下关键要素,分别是人的能动性和监督,技术的稳健性和安全性,隐私和数据管理,透明性,多样性、非歧视性和公平性,社会和环境福祉,问责。
日本医疗AI技术管理概况
日本药品和医疗器械局下设的人工智能及其在医疗领域的应用小组委员会于2016年成立,针对AI辅助医疗影像诊断和AI手术机器人提出了具体规范建议。首先,针对医疗AI技术的可塑性,PMDA提出了相关要求以确保新的更改不会损害设备的安全性和有效性;其次,针对深度学习算法带来的黑匣子问题,需要确保数据集的有效性与可靠性,详细描述网络结构、算法设计和功能,并通过一系列的输入来评估其输出性能,同时也应提前制定应对意外行为的相关规定;最后,是数据质量问题,包括上市前及上市后测试所需要的数据集。
启示与思考
保证有效性与安全性是医疗AI技术的前提
各国对于医疗AI技术的共同点或基本要求就是两个关键词:安全、有效。安全包括技术安全、数据安全与网络安全等,以保证患者的人体健康安全、隐私信息安全,将风险控制在可接受的水平;有效是指要达到预期的目的,即防病、治病的效果等。虽然AI技术医疗设备具有一定特殊性,但安全性与有效性依然是开展一切医疗AI技术监管与评估工作的前提。
建立基于风险等级的分类管理机制
建立基于风险等级的分类管理与评估机制是开展医疗AI技术监管与评估工作的重要手段。我国可依据医疗AI设备产品功能、使用形式、作用人群、技术透明度、数据安全性、算法特异性等,制订符合我国自身特点的医疗AI设备风险分类标准,并为不同AI设备分类设置特定的监管与评估机制。
注重上市后的持续监管与风险控制
上市后监测是非常重要且必不可少的环节。我国可以综合参考各国医疗AI设备上市后评估侧重点,对设备上市后在真实世界的有效性、不良事件监测、网络安全性、数据安全性、技术的可持续发展性等进行全方位的监控管理。
加强全生命周期的持续监管
考虑到医疗AI技术的特殊性,可采用深度学习等方法不断更新算法,从而达到更佳的使用效果。在算法的更新过程中,对医疗AI设备的初始评估结论可能不再适用,因此对医疗AI技术的评估应贯穿于产品的全生命周期。