摘 要 Abstract
本文介绍了国际监管科学创新中心(CIRS)对六大监管机构批准的新活性物质(NAS)的年度分析结果,重点分析了2021 年NAS 批准情况,并回顾了2012~2021 年的情况。通过分析可以看出,尽管中位批准时间可以作为考量监管机构工作效率和药物获批上市所需时间的重要指标,但同时也需要考虑其他因素,包括监管促进路径(FRP)、NAS 的国际化以及新数据来源[ 包括真实世界数据(RWD)]的使用等。
This R&D Briefing presents the annual analysis results of new active substance (NAS) approvals by the Centre for Innovation in Regulatory Science (CIRS). It focuses on the NAS approvals in 2021 while also reviewing the period from 2012 to 2021. The analysis highlights that while median approval time can be a marker of agency performance and the time required to make medicines available to patients, other factors need to be taken into account as well. This R&D Briefing focuses on factors such as facilitated regulatory pathways (FRP), internationalization of NAS, and the use of novel data sources, including realworld data (RWD).
关键词 Key words 监管机构;批准时间;监管促进路径
regulatory agency; approval time; facilitated regulatory pathway
1、 六大监管机构批准的总体情况
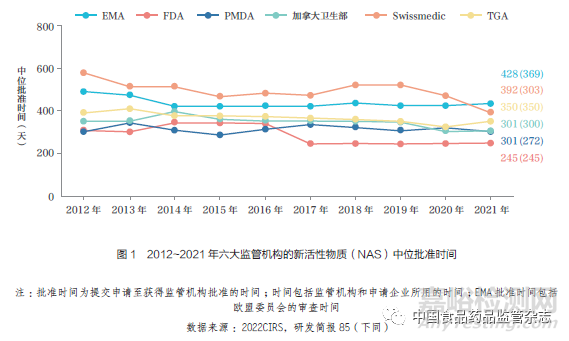
本文介绍了国际监管科学创新中心(CIRS)对六大监管机构批准的新活性物质(NAS)的年度分析结果,其中六大监管机构包括:欧洲药品管理局(EMA)、美国食品药品监督管理局(FDA)、日本药品和医疗器械管理局(PMDA)、加拿大卫生部、瑞士医药管理局(Swissmedic)和澳大利亚药品监督管理局(TGA)。2012~2021 年六大监管机构的NAS 中位批准情况,如图1所示。
上市许可中位批准时间出现差异归结于多种因素,包括监管机构的因素、产品因素和企业策略等。监管机构因素包括规定时间线的法律框架、提交或滚动提交前的程序、监管促进路径(例如加速评审)、各监管机构间的工作共享(例如Access联盟)以及科学评估后的活动(例如行政程序或标签谈判)。产品因素包括了各监管机构收到申请或审评的NAS 不同。企业策略的因素为根据提交申请时间或真实世界数据(RWD)等不同数据来源采用不同的数据包。
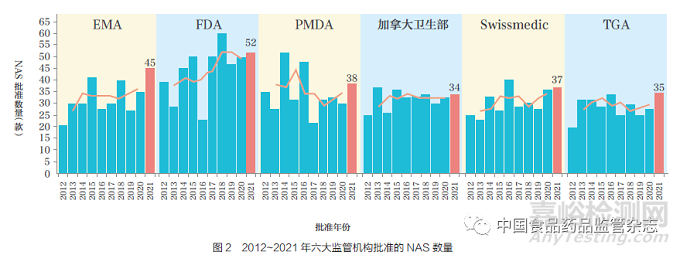
过去10 年, 六大监管机构批准的NAS 总数虽整体呈增加趋势, 但2017~2021 年,FDA 和加拿大卫生部的批准数量却趋于平稳。2021 年,FDA[ 药物评价和研究中心(CDER)与生物制品评价和研究中心(CBER)] 总计批准的NAS 数量(52 款)最多,如图2 所示。FDA 批准数量高于其他监管机构的可能原因是:①监管促进路径(FRP)的可及性;②由于FDA 批准的一些药物尤其小型企业申报的药物,尚未进行国际化。通过对比2012~2016 年和2017~2021 年这两个5 年批准的NAS数量可以发现,FDA 批准数量增幅最大,增加了39%,其次是EMA(18%)、Swissmedic(9%) 和加拿大卫生部(4%),而TGA 和PMDA 批准数量则分别减少了3% 和21%。各监管机构在产品批准数量方面的差异可能受到诸多因素的影响,例如,申请人根据企业自身的规模、未满足的临床需求和审评速度,针对不同监管机构采取了不同申报策略。
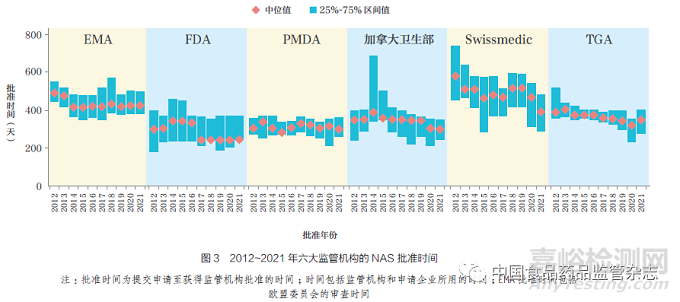
2021 年,FDA 的中位批准时间最短(245 天), 这可能归因于FRP的广泛应用, 其次是加拿大卫生部和PMDA(均为301 天)、TGA(350 天)、Swissmedic(392 天) 和EMA(428天),如图3 所示。在过去20 年中,尽管六大监管机构的批准时间均有所缩短,但各机构在中位批准时间方面仍存在差异(例如FDA 和EMA 的批准时间相差183 天)。然而,从提交申请至科学评估结束的中位时间差异已缩小(例如FDA和EMA 相差124 天)。FDA、加拿大卫生部和TGA 的总体批准时间和至科学评估结束时间相近,这表明科学评估后没有或很少有其他相关程序。2020~2021年,Swissmedic 的中位批准时间差最大,2020 年为173 天、2021 年为89天,减少了78 天,主要是由于科学评估后的时间(例如标签谈判)减少。2021年TGA 批准时间较2020 年延长,这可能是由于新冠疫情导致的工作量增加。
2、共同审评情况
2.1 六大监管机构共同批准
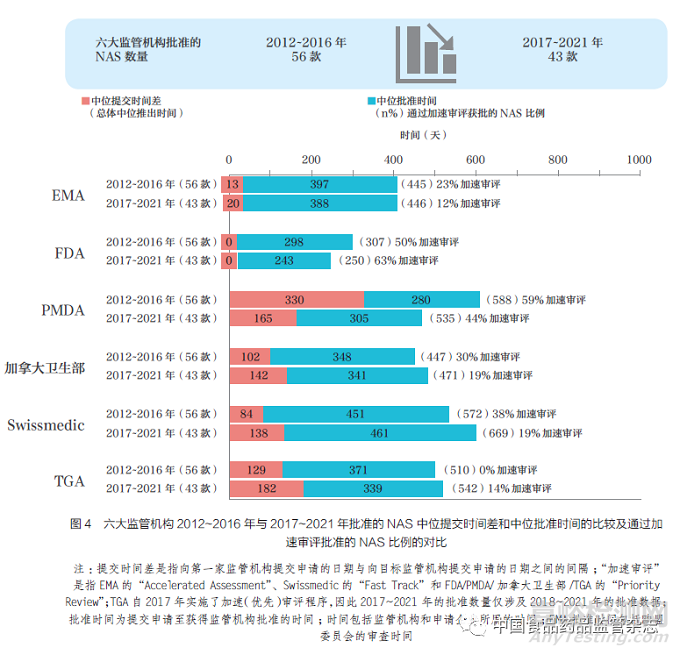
为了进行监管机构工作绩效基准的对标评估,对六大监管机构已批准的药物进行审评十分重要。这项评估工作,将过去10 年分为两个时间段(即2012~2016年和2017~2021 年),以发现变化趋势。与以往分析中发现批准产品的数量增加相比,六大监管机构在5 年内批准的产品数量减少,从2012~2016 年批准了56款NAS,到2017~2021 年只批准了43款NAS,这表明国际化的进程可能趋于平稳。不同国家和地区注册审批时间可能受到诸多因素的影响,包括提交时间差和批准时间等。例如企业申报策略以及为解决未满足的医疗需求而使用快速通道的情况。2017~2021 年,FDA 的总体中位注册审批时间最短(250 天),这是因为企业最先向FDA 申报,并且由于加速审评的更广泛使用,FDA 的监管审评时间加快(63%),其次是EMA(446 天)、加拿大卫生部(471 天)、PMDA(535天)、TGA(542 天) 和Swissmedic(669 天),如图4 所示。
向EMA 提交申请与FDA 几乎是同时发生, 其次是加拿大卫生部、Swissmedic、TGA 和PMDA。本文中向监管机构提交申请的顺序发生了变化:主要是由于之前发现向PMDA 提交申请的时间比向加拿大卫生部、Swissmedic和TGA 提交的时间晚,但目前这几个监管机构提交申请的时间相同。事实上,PMDA 的中位提交时间差从2012~2016年的330 天缩短至2017~2021 年的165 天,减少了一半。
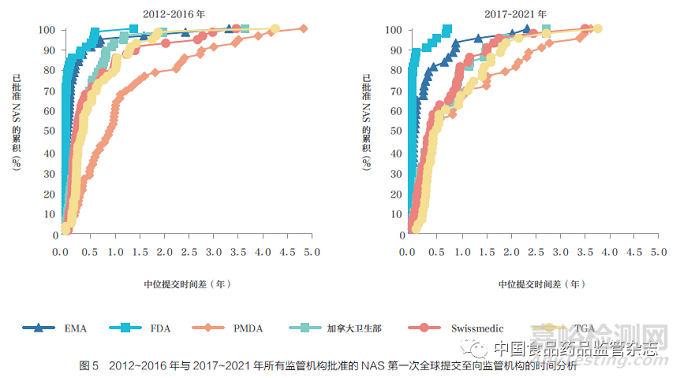
本文通过比较六大监管机构2012~2016 年(56 款)与2017~2021年(43 款) 间批准的NAS 提交时间差分布,进一步分析了企业申报策略的差异。结果表明,PMDA 的中位提交时间差由2012~2016 年的1 年缩短至2017~2021 年半年左右,如图5 所示。2017~2021 年PMDA 分布曲线的收紧,表明第一次全球提交后向PMDA 提交所需的时间与加拿大卫生部、Swissmedic和TGA 的时间相近。
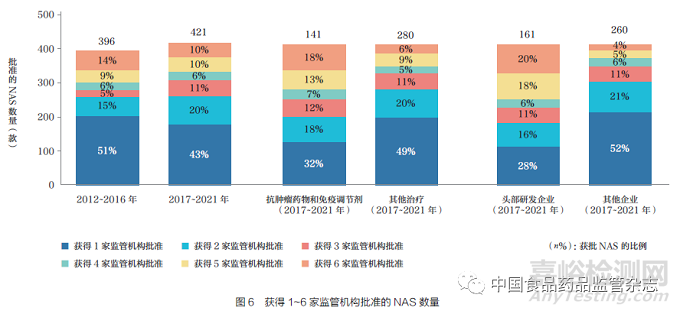
通过比较每款NAS 获批的监管机构数量,本文对产品的国际化情况进行了研究。2012~2016 年与2017~2021年比较表明,尽管六大监管机构批准的产品数量没有呈现明显的增加趋势,但获得两家或以上监管机构批准的NAS比例由2012~2016 年的49% 增加至2017~2021 年的57%。进一步探索2017~2021 年影响国际化的可能因素,在比较治疗领域和基于研发支出的企业规模方面,观察到存在较大的差异。在治疗领域,18% 的抗肿瘤药物和免疫调节剂NAS 获得六大监管机构的批准,而其他治疗领域为6% ;在研发投入水平方面,来自头部企业(2021 年研发支出超过30亿美元的制药企业)的NAS 有20% 获得了六大监管机构的批准,而其他较小型企业的NAS 获批比例为4%,如图6 所示。
2.2 Access 工作共享联盟
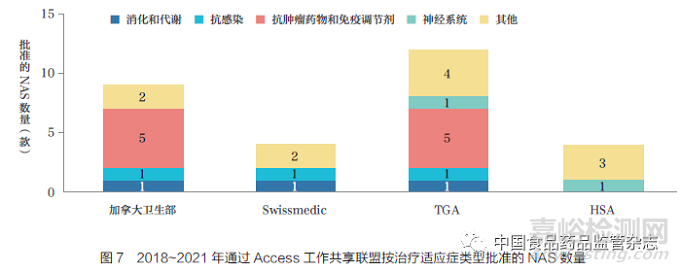
Access 联盟是一个由“志同道合”的监管机构于2007 年成立的中等规模的联合体,旨在促进更多合作和提升监管一致性,其目标是最大限度地开展国际合作,减少重复性审评,提升各监管机构的效能,以确保患者及时获得高质量、安全和有效的药物。各监管机构作为Access 工作共享联盟的成员,负责审评申请资料的不同部分。尽管各监管机构之间共享审评结果,但每家监管机构均有权对新药的批准(上市许可)与否独立做出决定。目前,这种“共享”模式是否能成为一种联盟的监管机构在区域和跨区域间共享资源、简化与企业互动的模式备受关注。本文对实施新化学实体工作共享倡议的加拿大卫生部、Swissmedic、TGA 和新加坡卫生科学管理局(HSA)2018~2021 年的NAS批准情况进行了分析,各监管机构共批准了12 款NAS,如图7 所示。TGA 是参与所有12 款NAS 工作共享最多的机构(12 款),主要是抗肿瘤药物和免疫调节剂,其次是加拿大卫生部(9 款)、HSA(4款)和Swissmedic(4 款)。2021 年1月,英国药品和健康产品管理局(MHRA)在该倡议中发起了工作共享申请,但当年没有NAS 获批。
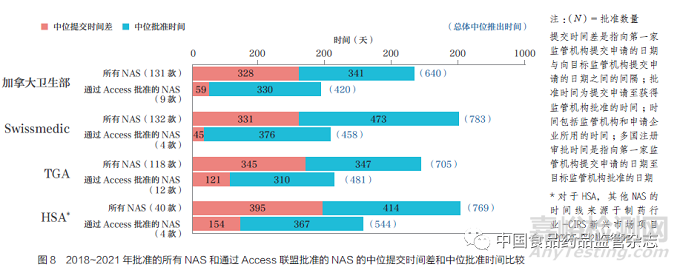
对于评估的所有监管机构, 与2018~2021 年批准的所有NAS 相比,通过Access 工作共享联盟批准的NAS的中位提交时间差和中位批准时间更短,如图8 所示,表明工作共享机制对不同国家和地区注册审批时间(提交时间差+批准时间)具有积极影响。就总体中位注册审批时间而言,与2018~2021 年批准的所有NAS 相比,Swissmedic 通过Access 批准NAS 的中位注册审批时间缩短326 天,其次是HSA(225 天)、TGA(224 天)和加拿大卫生部(220 天)。
2.3 Orbis 计划
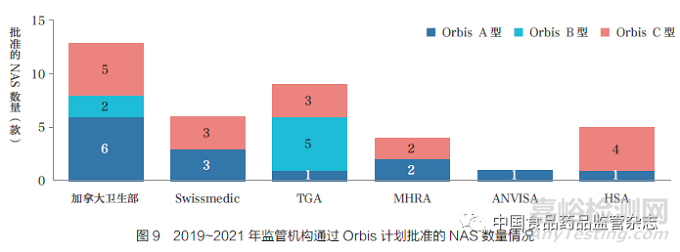
Orbis 计划是FDA 肿瘤卓越中心(OCE) 发起的一项倡议, 旨在让全球患者更快地获得有前景的癌症治疗。Orbis 计划的合作伙伴合作审评癌症药物提交的资料。根据FDA 与合作伙伴的提交时间表,Orbis 计划的提交类型分三种:A 型,提交基本上同时进行;B 型,从向FDA 提交到向合作伙伴提交有超过30 天的延迟;C 型,在FDA 已经采取监管行动后提交。2019~2021 年通过Orbis 计划批准的NAS 情况,如图9 所示,加拿大卫生部批准的NAS 数量最多(13 款, 大部分为Orbis A 型),其次是TGA(9 款)、Swissmedic(6款)、HSA(5 款)、MHRA(4 款)和巴西国家卫生监督局(ANVISA)(1 款)。最常使用的Orbis 类型为C 型,表明最常发生的情况是FDA 分享其已完成的审评文件,而不是同时进行审评。
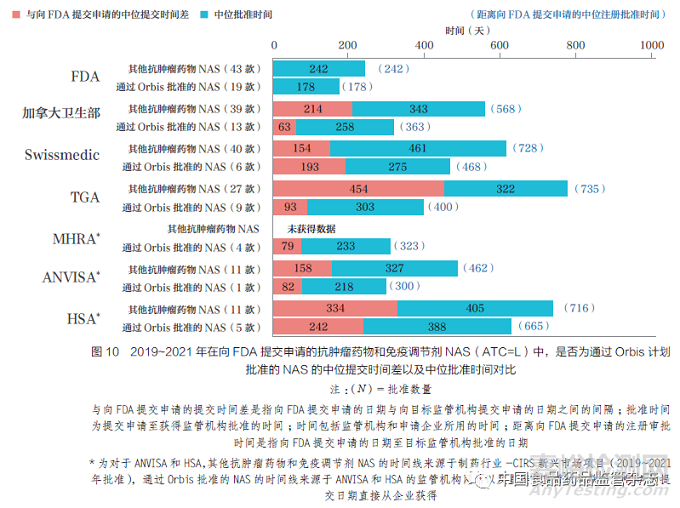
与其他方式批准的抗肿瘤药物和免疫调节剂的时间相比,Orbis 批准缩短了向FDA 提交申请的不同国家和地区中位注册审批时间,由于与FDA 的提交时间差缩短,批准时间也缩短,如图10 所示,也表明了全球监管合作可以让肿瘤患者更快地获得新疗法。
3、 影响六大监管机构NAS 批准的因素
3.1 审评类型
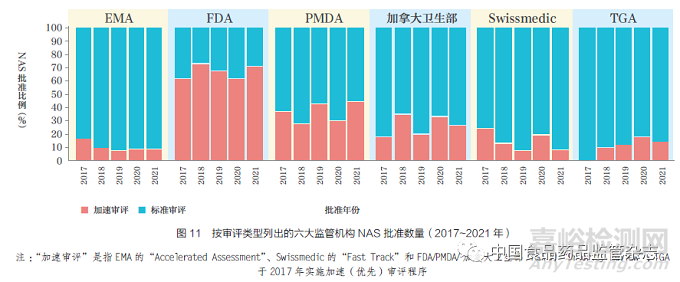
六大监管机构均已设立加速审评程序,以加快具有前景的NAS 审评过程,如图11 所示。2021 年,FDA 的加速审评与标准审评比值最高(71%),其次是PMDA(45%)、加拿大卫生部(26%)、TGA(14%)、EMA(9%)和Swissmedic(8%)。TGA 自2017年开始实施优先审评体系;2018 年和2019 年分别加速审评批准了3 款NAS,2020 年和2021 年分别加速审评批准了5 款NAS。FDA 的加速审评比例一直较高,从2012~2016 年的50% 增加到2017~2021 年的68%。Swissmedic在2021 加速审评批准了3 款NAS,EMA 加速审评批准了4 款。其中EMA加速审评数量较低的部分原因可能是申请人需要满足时间线的要求,否则将仍使用标准审评程序进行审评。例如,2021年,EMA 将最初指定为加速审评的9 款NAS 转为标准审评,而申请人要求加速审评7 款NAS,被EMA 拒绝。
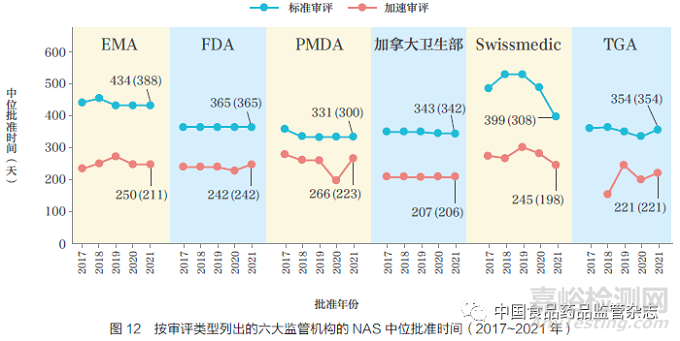
2021 年,EMA 是加速审评和标准审评之间中位批准时间差异最大的监管机构(184 天),PMDA 的差异最小(65天),Swissmedic(154 天),加拿大卫生部(136 天),TGA(133 天),FDA(123 天),如图12 所示。值得注意的是,对于Swissmedic 来说,在科学评估结束后进行的额外标签谈判程序中,加速审评产品所用的时间约为标准审评的1/2,这表明对于高度未满足需求的产品,标签谈判和其他行政程序正在以更快的速度进行。TGA 通过引入加速通道批准的5 款产品的中位审评时间为221 天,与其他监管机构一致。
3.2 罕见病药
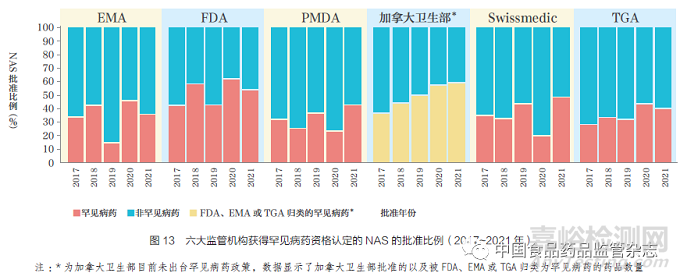
2021 年,各监管机构授予罕见病药资格的NAS 获批比例均较高,其中TGA(40%),EMA(36%),PMDA(42%),Swissmedic(49%),FDA(54%),如图13 所示。目前,尽管加拿大卫生部未出台罕见病药相关政策,但其在2021 年批准的NAS 中有59% 被FDA、EMA 以及TGA 归类为罕见病药。
2017~2021 年,各监管机构批准的罕见病药比例逐年变化,但普遍呈增加趋势,可能是由于疾病分层和企业研发管线的不断扩大,并且与各监管机构为解决未满足的医疗需求而增加投入相符。监管机构间的差异可能是由于提交给各监管机构的产品类型不同以及各监管机构对罕见病药认定标准不同,以及申请人提交的适应症不同。
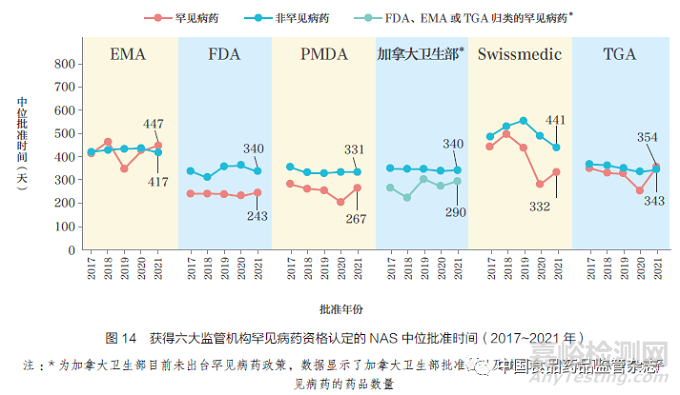
本文对2017~2021 年六大监管机构批准罕见病药和非罕见病药的时间线进行了比较, 如图14 所示。2021 年,FDA 的罕见病药中位批准时间最短(243天),可能由于大部分产品为通过加速审评获得批准。2021 年,PMDA 的罕见病药中位批准时间位居第二(267 天)。在日本获批的所有罕见病药NAS 均通过加速审评进行,这是因为加速审评是PMDA 为解决未满足的医疗需求而实施的激励政策。目前,加拿大卫生部未出台罕见病药相关政策,但其在2021 年批准的20 款NAS 已被FDA、EMA 以及TGA 归类为罕见病药,中位批准时间为290 天。2021 年EMA 批准16 种罕见病药,中位批准时间为447 天,其中获得快速审评的罕见病药占13%,而2019 年获得快速审评的罕见病药占50%,2021 年度批准的4 种罕见病药的中位批准时间为352 天。
3.3 监督促进路径(FRP)
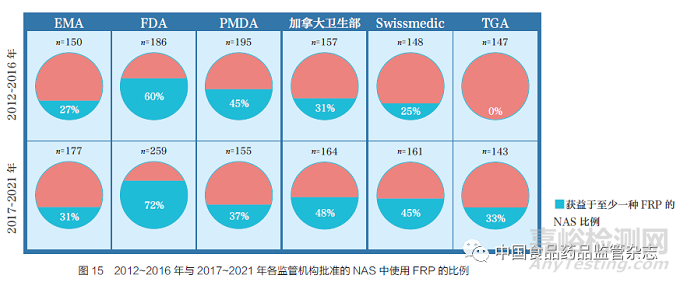
2017~2021 年与2012~2016 年相比,大部分监管机构对FRP 的使用都有所增加。FDA 是使用FRP 最多的监管机构,其中2017~2021 年72% 的NAS 至少使用了一种FRP,其次是加拿大卫生部(48%)、Swissmedic(45%)、PMDA(37%)、TGA(33%)和EMA(31%),如图15 所示。TGA 是通过FRP 批准NAS 数量增加最多的监管机构,这是由于TGA 最近实施了5 种FRP[ 优先审评、临时批准、国外同类监管机构(COR)审评、Access 工作共享联盟和Orbis 计划]。对比2012~2016 年与2017~2021 年,PMDA 是唯一通过FRP 批准NAS 比例略有下降的监管机构。
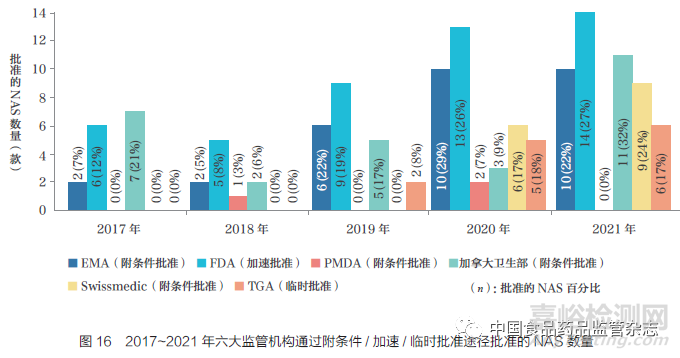
在过去5 年中,六大监管机构的附条件/ 加速/ 临时批准的数量普遍增加。2017~2021 年,FDA 是使用这些途径批准NAS 数量最多的监管机构,批准了47 款, 其次是EMA(30 款)、加拿大卫生部(28 款)、TGA(13 款)、Swissmedic(15 款)和PMDA(3 款),如图16 所示。此外,六大监管机构通过这些途径批准的NAS 数量呈逐年增加趋势,并且在2020 年和2021 年为最高,这可能与新冠疫情相关产品有关。
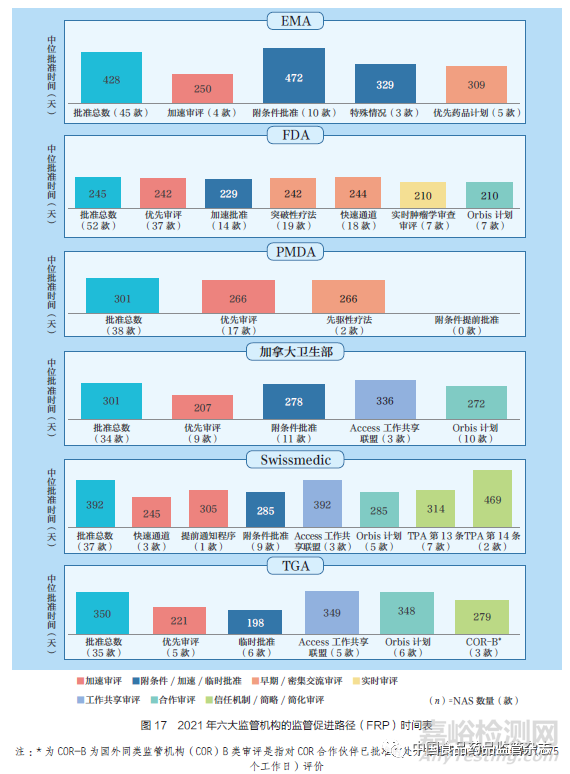
2021 年不同FRP 的NAS 中位批准时间,如图17 所示。
3.4 治疗领域
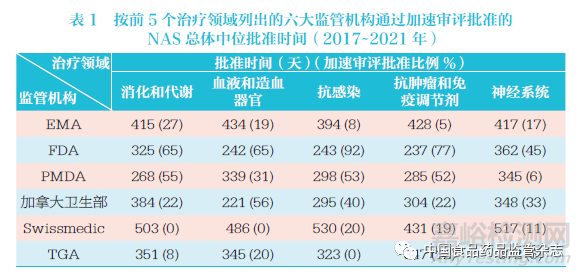
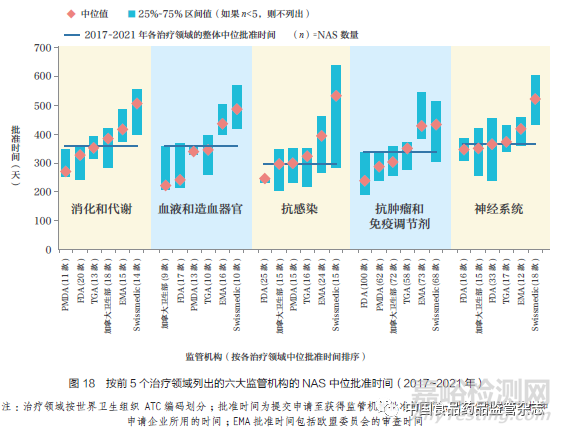
2017~2021 年六大监管机构中在前5 的治疗领域中批准的NAS 数量占全部批准数量的77%,其中抗肿瘤药物和免疫调节剂在前5 个治疗领域批准数量中占53%,如图18 所示。抗感染治疗药物的批准速度略快,其NAS 中位批准时间为296 天,抗肿瘤药物和免疫调节剂NAS 为337 天,血液和造血器官治疗用NAS 为357 天,消化和代谢领域NAS为358 天,神经系统领域NAS 为365 天。PMDA 在消化和代谢以及神经系统领域的批准速度最快,FDA 在抗肿瘤药物和免疫调节剂以及抗感染药物领域的批准速度最快。这可能是对于这5 个治疗领域的药物,各监管机构使用快速审评通道的频率更高,如表1 所示。但同时,如图18 所示(即25%~75% 区间值条形图),各监管机构在不同的治疗领域的批准时间也有较大差异。
3.5 新数据来源
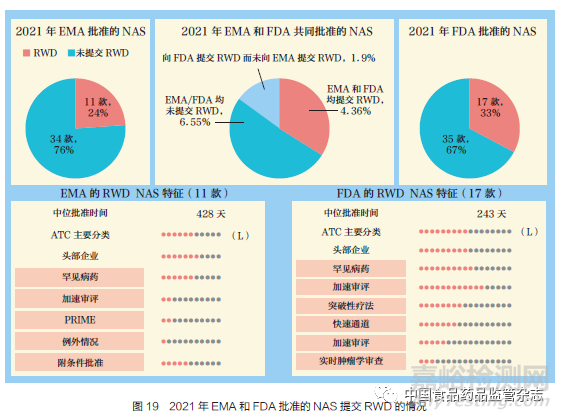
随着监管格局的演变,证据来源正在发生变化。这些变化包括申请中更多地使用真实世界数据(RWD),以及对患者体验数据(PED)的收集和使用。本文对2021 年EMA 和FDA 在申请中采用RWD 的批准进行了分析。EMA 批准的NAS 中有24% 申报资料采用RWD,FDA 为33%。RWD 是指从多种来源(例如电子健康记录)定期收集的与患者健康状况和(或)医疗保健相关的数据。2021 年, 获得EMA 和FDA 共同批准的NAS 有11 款, 如图19 所示, 其中两家监管机构有4 款都提交了RWD 资料,有6 款都没有提交RWD 数据,剩余1 款NAS 仅向FDA 提交了RWD 资料,但未向EMA 提交。这些NAS 主要是来自头部企业的抗肿瘤药物和免疫调节剂(ATC=L),并且都得益于多种FRP的运用,如EMA 的附条件批准和FDA的加速审评(优先审评)。
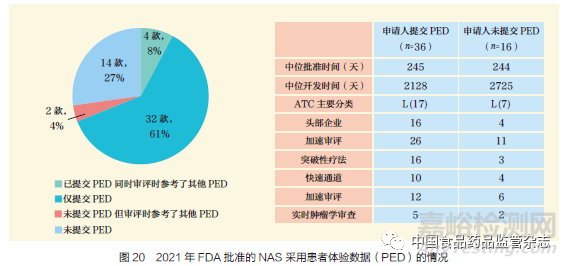
患者体验数据(PED)是指系统地收集与患者有关的体验、观点、需求和偏好等有意义的数据。2021 年,52 款NAS获得FDA 批准。其中,38 款使用了PED,这当中的36 款的PED 由申请人提交;36 款NAS 中,有4 款被监管机构认为申请人需要补充提交额外的PED作为审评的重要内容。其余2 款,尽管申请中没有提交PED,但审评员仍将其他PED 作为审评的重要部分,如图20 所示。
4、 2021 年六大监管机构批准的NAS 情况汇总
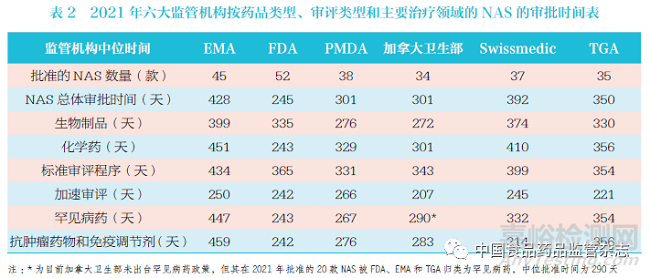
本文按药品类型、审评类型和主要治疗领域,对六大监管机构在2021 年批准NAS 的审批时间进行了汇总,见表2。
4.1 2021 年EMA 批准的NAS 情况
与其他监管机构不同的是,EMA 批准时间包括了欧盟委员会的审查时间。2021 年EMA 共批准了45 款NAS,中位批准时间为428 天(至科学评估结束的时间为369 天),其中欧盟委员会中位时间为57 天,监管机构中位时间为244天,申请企业中位时间为133 天。药物类型方面,2021 年EMA 批准17 款生物制品NAS,中位批准时间为399 天;批准28 款化学药NAS,中位批准时间为451 天;批准21 款抗肿瘤药物和免疫调节剂NAS,中位批准时间为459天;批准其他治疗领域的24 款NAS,中位批准时间为416 天。资格认定和审评类型方面,2021 年批准16 款罕见病药NAS,中位批准时间为447 天,比2021 年批准的29 款非罕见病药NAS的中位批准时间缩短30 天。加速审评方面,值得注意的是,EMA 的“加速审评”指的是“ 加速评估”,2021 年EMA 加速审评批准4 款NAS,中位批准时间为250 天,比2021 年标准审评程序批准的41 款NAS 的中位批准时间缩短184 天。
提交时间差是指向第一家监管机构提交申请的日期与向目标监管机构提交申请的日期之间的间隔。2021 年EMA 批准的NAS 中,22% 最先获得EMA 批准,或是在FDA、PMDA、加拿大卫生部、Swissmedic 或TGA 最先批准后的1 个月内获得EMA 批准。2021 年EMA批准的NAS 中,78% 最先获得FDA、PMDA、加拿大卫生部、Swissmedic或TGA 批准,或是在这五家监管机构批准1 个月后才获得EMA 批准,这些NAS 在EMA 的中位提交时间差为97 天。
4.2 2021 年FDA 批准的NAS情况
2021 年FDA(CDER 和CBER)共批准了52 款NAS,中位批准时间为245 天,对于批准的NAS,87% 为首轮批准,13% 为二轮批准。药物类型方面,2021 年批准17 款生物制品NAS,中位批准时间为335 天;批准35 款化学药NAS,中位批准时间为244 天;批准24款抗肿瘤药物和免疫调节剂NAS,中位批准时间为242 天;批准其他治疗领域的28 款NAS,中位批准时间为284 天。资格认定和审评类型方面,2021 年批准28 款罕见病药NAS,中位批准时间为243 天,比2021 年批准的24 款非罕见病药NAS 的中位批准时间缩短97 天。加速审评方面,FDA 的“加速审评”是指“ 优先审评”,2021 年FDA 加速审评批准37 款NAS,中位批准时间为242天,比2021 年标准审评程序批准的15款NAS 的中位批准时间缩短123 天。
2021 年FDA 批准的NAS 中,85% 最先获得FDA 批准,或是在EMA、PMDA、加拿大卫生部、Swissmedic或TGA 最先批准后的1 个月内获得FDA 批准。2021 年FDA 批准的NAS 中,15% 最先获得EMA、PMDA、加拿大卫生部、Swissmedic 或TGA 批准,或是在这五家监管机构批准1 个月后才获得FDA 批准。这些NAS 在FDA 的中位提交时间差为55 天。
4.3 2021 年PMDA 批准的NAS 情况
2021 年PMDA 共批准38 款NAS,中位批准时间为301 天( 至科学评估结束的时间为272 天)。药物类型方面,2021 年批准16 款生物制品NAS, 中位批准时间为276 天;批准22 款化学药NAS,中位批准时间为329 天;批准14 款抗肿瘤药物和免疫调节剂NAS,中位批准时间为276 天;批准其他治疗领域的24 款NAS,中位批准时间为329天。资格认定和审评类型方面,2021 年批准16 款罕见病药NAS,中位批准时间为267 天,比2021 年批准的22 款非罕见病药NAS 的中位批准时间缩短64天。加速审评方面,2021 年加速审评批准17 款NAS,中位批准时间为266 天,比2021 年标准审评程序批准的21 款NAS 的中位批准时间缩短65 天。
2021 年PMDA 批准的NAS中,26% 最先获得PMDA 批准, 或是在EMA、FDA、加拿大卫生部、Swissmedic 或TGA 最先批准后的1 个月内获得PMDA 批准。2021 年PMDA批准的NAS 中,74% 最先获得EMA、FDA、加拿大卫生部、Swissmedic 或TGA 批准,或是在这五家机构批准1 个月后才获得PMDA 批准。这些NAS 提交至PMDA 的中位提交时间差为596 天。
4.4 2021 年加拿大卫生部批准的NAS 情况
2021 年加拿大卫生部共批准了34款NAS,中位批准时间为301 天(至科学评估结束的时间为300 天)。药物类型方面,2021 年批准13 款生物制品NAS,中位批准时间为272 天;批准21款化学药NAS,中位批准时间为301天;批准20 款抗肿瘤药物和免疫调节剂NAS,中位批准时间为283 天;批准其他治疗领域的14 款NAS,中位批准时间为343 天。资格认定和审评类型方面,目前,加拿大卫生部未出台罕见病药相关政策,但其在2021 年批准的20 款NAS被FDA、EMA 或TGA 归类为罕见病药,中位批准时间为290 天。加速审评方面,2021 年加速审评批准9 款NAS,中位批准时间为207 天,比2021 年标准审评程序批准的25 款NAS 的中位批准时间缩短136 天。
2021 年加拿大卫生部批准的NAS 中,6% 最先获得加拿大卫生部批准, 或是在EMA、FDA、PMDA、Swissmedic 或TGA 最先批准后的1 个月内获得加拿大卫生部批准。2021 年加拿大卫生部批准的NAS 中,94% 最先获得EMA、FDA、PMDA、Swissmedic或TGA 批准,或是在这五家机构批准1个月后才获得加拿大卫生部批准。这些NAS 提交至加拿大卫生部的中位提交时间差为347 天。
4.5 2021 年Swissmedic 批准的NAS 情况
2021 年Swissmedic 共批准37 款NAS, 中位批准时间为392 天( 至科学评估时间为303 天)。药物类型方面,2021 年批准11 款生物制品NAS,中位批准时间为374 天;批准26 款化学药NAS,中位批准时间为410 天;批准19款抗肿瘤药物和免疫调节剂NAS,中位批准时间为314 天;批准18 款其他治疗领域的NAS,中位批准时间为460 天。资格认定和审评类型方面,2021 年批准18 款罕见病药NAS,中位批准时间为332 天,比2021 年批准的19 款非罕见病药NAS 的中位批准时间缩短109 天。加速审评方面,Swissmedic“ 加速审评”指的是“Fast-Track procedure”,2021 年Swissmedic 加速审评批准3款NAS,中位批准时间为245 天,比2021 年标准审评程序批准的34 款NAS的中位批准时间缩短154 天。
2021 年Swissmedic 批准的NAS中,3% 最先获得Swissmedic 批准,或是在FDA、EMA、PMDA、加拿大卫生部或TGA 最先批准后的1 个月内获得Swissmedic 批准。2021 年Swissmedic 批准的NAS 中,97% 最先获得FDA、EMA、PMDA、加拿大卫生部或TGA 批准,或是在这五家机构批准1 个月后才获得Swissmedic 批准。这些NAS 在Swissmedic 的中位提交时间差为351 天。
4.6 2021 年TGA 批准的NAS情况
2021 年TGA 共批准35 款NAS,中位批准时间为350 天。药物类型方面,2021 年批准14 款生物制品NAS, 中位批准时间为330 天;批准21 款化学药NAS,中位批准时间为356 天;批准9 款抗肿瘤药物和免疫调节剂NAS,中位批准时间为356 天;批准其他治疗领域的26 款NAS,中位批准时间为350天。资格认定和审评类型方面,2021 年批准14 款罕见病药NAS,中位批准时间为354 天,比2021 年批准的21 款非罕见病药NAS 的中位批准时间缩短11天。加速审评方面,TGA 的“加速审评”指的是2017 年TGA 实施的“PriorityReview” 程序,2021 年TGA 加速审评批准5 款NAS,中位批准时间为221天,比2021 年标准审评程序批准的30款NAS 的中位批准时间缩短133 天。
2021 年TGA 批准的NAS 中,14% 最先获得TGA 批准, 或是在FDA、EMA、PMDA、加拿大卫生部或Swissmedic 最先批准后的1 个月内获得TGA 批准。2021 年TGA 批准的NAS 中,86% 最先获得FDA、EMA、PMDA、加拿大卫生部或Swissmedic批准,或是在这五家机构批准1 个月后才获得TGA 批准。这些NAS 在TGA的中位提交时间差为413 天。
专家点评
本文介绍了国际监管科学创新中心(CIRS)对六大监管机构批准的新活性物质(NAS)的年度分析结果,这六大监管机构分别是欧洲药品管理局(EMA)、美国食品药品监督管理局(FDA)、日本药品和医疗器械管理局(PMDA)、加拿大卫生部、瑞士医药管理局(Swissmedic)和澳大利亚药品监督管理局(TGA)。
过去十年,在不同的监管机构获批NAS 数量整体呈逐渐增加的趋势, 但FDA 和加拿大卫生部获批数量趋于平稳;从审批周期上来说,以FDA 的中位批准时间最短,本文推测归因于广泛应用监管促进路径;另外本文从共同审批情况对提交时间差和审批时间,以及在不同监管机构之间的差异进行了总结和分析,并分析了Access 工作联盟和Orbis 计划对审评效率的影响。本文详实地介绍了六大监管机构NAS 批准时间的影响因素,包括加速审评程序,罕见病药,监管促进路径,治疗领域不同,新数据来源(如真实世界数据)等方式和途径。
本文以全球的视角,高度概括了六大监管机构审批效率的对比分析,阐释了提高审批效率的多种因素,以及全球化发展带来的监管效率的提升。尤其是丰富的数据分析维度,清晰地显示了监管科学的变化和进步,对读者更好地理解全球监管和审批的发展趋势有重要的参考价值,为我国监管方向提供借鉴意义。
引用本文
Juan Lara,Magda Bujar,Neil McAuslane,编译/ 张颖.2012~2021 年国外六大监管机构新药审评情况分析:聚焦监管促进路径和国际化[J].中国食品药品监管.2023.06(233):12-29.