您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-09-20 10:48
TGA更新
近日,澳大利亚TGA 发布了有关唯一器械标识 (UDI) 法规、基本原则合规要求和有源医疗器械指南的多项更新,具体内容如下:
PART1 澳大利亚UDI监管框架咨询文件更新日期:2022年8月23日
澳大利亚政府正在对澳大利亚的医疗产品监管进行重大改革。改革将继续提高澳大利亚医疗器械的安全性、性能和质量,并改善需要医疗器械的患者的健康结果。作为政府改革计划的一部分,TGA 发布了这份咨询文件,并于2022年8月31日至2022年10月11日开放讨论。
本咨询文件是 TGA 发布的第三份咨询文件,内容涉及澳大利亚实施医疗器械唯一器械识别 (UDI) 系统。第三次咨询涉及拟议监管框架的细节,包括寻求以下方面的反馈:
• 接受欧洲和美国合规标签的影响
• 通过分阶段实施方法加速交付效益
• 应用 UDI 的范围和豁免
• 在器械的整个生命周期内提供和维护数据
• UDI 相关费用和收费
• UDI 标签和支持文件
• 任何潜在的监管负担
• 在更广泛的医疗保健环境中使用
PART2 TGA基本原则合规指南更新日期:2022年8月19日
澳大利亚监管机构发布了关于基本原则的新指南,这是关于医疗器械和体外诊断 (IVD) 安全和性能的立法要求。
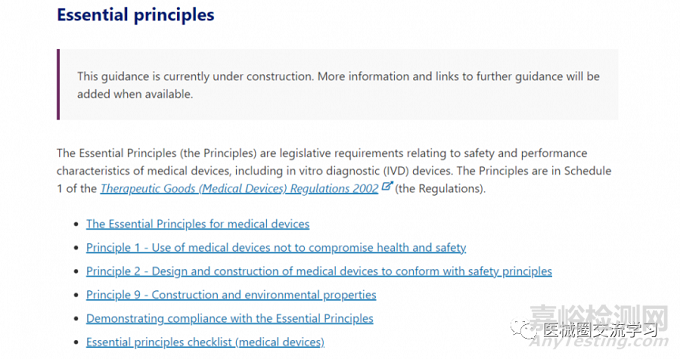
尽管与基本原则相关的在线内容仍在开发中,但 TGA 已发布以下信息:
• 医疗器械的基本原则
• 原则1-不损害健康和安全的医疗器械使用原则
• 原则2-医疗器械的设计和制造符合安全原则
• 原则9-医疗器械结构和环境特性原则
• 证明遵守基本原则的指南
• 基本原则清单(医疗器械)
PART3 有源医疗器械监管要求指南更新日期:2022年7月 Version 1.0
TGA更新了有源医疗器械监管要求指南。更新后的指南涵盖了有关有源器械的定义和要求,内容包括:
• 有源医疗器械要求总结
• 不同形式的能量
• 电子医疗器械安全标准
• 具有电信功能或无线电发射器的医疗器械
• 放射性医疗器械
• 辐射医疗器械
• 可编程和编程医疗器械,包括软件

来源:Internet


