您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-08-11 08:47
本文主要介绍了杭州可帮基因科技有限公司研发的医疗器械“肿瘤组织起源基因检测试剂盒 (PCR荧光探针法)”的临床前研发实验。
一、肿瘤组织起源基因检测试剂盒 (PCR荧光探针法)的产品主要组成成分
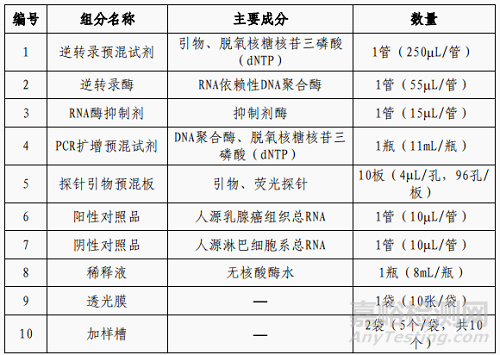
试剂盒由以下组分组成,主要组成成分见表 1。
表 1 试剂盒主要组成成分
二、肿瘤组织起源基因检测试剂盒 (PCR荧光探针法)的产品预期用途
本产品适用于定性检测组织分化程度较差或疑似转移的实体肿瘤患者的福尔马林固定、石蜡包埋组织样本中 90 个组织特异基因表达模式(Gene Expression Pattern),用于判别肿瘤组织起源,具体包括:乳腺癌、宫颈癌、结直肠癌、胃及食管癌、肾癌、肝胆肿瘤、肺癌、黑色素瘤、神经内分泌肿瘤、卵巢癌、前列腺癌、生殖细胞肿瘤、甲状腺癌和尿路上皮癌。
本产品与《肿瘤组织起源基因分析软件》配合使用,不用于区分原发性肿瘤与转移性肿瘤。在恶性肿瘤病理检查过程中,对于不能排除为转移性肿瘤的患者,本产品可为病理医生诊断肿瘤的类型和组织起源提供支持;但在确定肿瘤分期、评估预后和指导治疗等方面,本产品不能替代免疫组化。同时,本产品的检测结果不能作为癌症诊断的唯一依据。病理医生还应参考病史信息、影像学检查和其他病理检查结果,对受检标本的肿瘤类型和组织起源进行综合判断,出具诊断报告。本产品不适用于淋巴瘤和经脱钙处理的骨肿瘤样本。
病理诊断是当前肿瘤诊断的金标准,而免疫组化检测则是病理诊断中对肿瘤进行分型的基础,对于肿瘤分化程度较差(HE切片上缺少肿瘤细胞起源的特征)或者疑似转移性肿瘤尤为重要。肿瘤的分型通常需要联合数个免疫组化抗体,分步骤地进行检测,病理医生往往只能选取数量有限的免疫组化抗体进行检测。免疫组化用于肿瘤诊断所面临的挑战还包括,对于部分肿瘤无法找到特异性的免疫组化抗体。当缺乏特异性的免疫组化标记或少数非特异性免疫组化标记为阳性时,病理诊断往往只能给出较为模糊的诊断结果。国内外文献报道,转移性肿瘤的基因表达谱与转移部位组织的基因表达谱存在差异,而与其原发部位组织的基因表达谱更相似,提示肿瘤在其发生、发展、转移的过程中,始终保留其组织起源的分子特征。因此,基因表达谱检测可在分子水平揭示肿瘤的组织起源,进而实现对肿瘤的分型。
三、肿瘤组织起源基因检测试剂盒 (PCR荧光探针法)的产品包装规格
10 测试/盒
四、肿瘤组织起源基因检测试剂盒 (PCR荧光探针法)的产品检验原理
该产品基于实时荧光 PCR 平台,检测肿瘤样本 RNA 中组织特异基因的表达模式,并与参考数据库中已知肿瘤类型的基因表达模式进行比对,判断待测肿瘤样本组织起源。该产品利用特异引物对 90 个组织特异基因进行 PCR 扩增,并通过 TaqMan-MGB 探针对扩增产物进行检测,在实时荧光PCR平台上获取样本组织特异基因的表达模式。采用《肿瘤组织起源基因分析软件》对待测样本的基因表达模式进行分析,软件可自动比较待测样本与已知组织起源的肿瘤基因表达模式之间的相关性,从而判断待测肿瘤样本的组织起源。《肿瘤组织起源基因分析软件》参考数据库涵盖根据组织细胞起源和解剖学部位定义的 14 种肿瘤类型,具体包括:乳腺癌、宫颈癌、结直肠癌、胃及食管癌、肾癌、肝胆肿瘤、肺癌、黑色素瘤、神经内分泌肿瘤、卵巢癌、前列腺癌、生殖细胞肿瘤、甲状腺癌及尿路上皮癌。该产品选用人源管家基因作为内部参照(以下简称内参)系统,对样本 RNA 提取、逆转录和 PCR 反应过程进行质量控制。
五、肿瘤组织起源基因检测试剂盒 (PCR荧光探针法)的主要原材料
1.主要原材料的选择
该产品的主要原材料包括引物、探针、dNTPs、DNA 聚合酶、随机引物、逆转录酶及对照品等。原材料均通过外购的方式获得。可帮基因对主要原材料进行了供应商的选择,通过功能性实验筛选出合格供应商,制定了各主要原材料的技术要求和质量标准并经检验合格。
2.企业参考品和质控品设置情况
该产品企业参考品包括阳性参考品、阴性参考品、检测限参考品和重复性参考品。质控品分为阳性对照品和阴性对照品。企业参考品的主要原材料为临床组织样本。阳性参考品包括28 种,分别为该产品涵盖的 14 种肿瘤类型的 FFPE 肿瘤组织样本。阴性参考品包括 8 种,分别为该产品不涵盖的 5 种肿瘤类型的 FFPE 肿瘤组织样本,以及 3 种 FFPE 正常组织样本。检测限参考品包括 15 种,分别为 14 种肿瘤类型最低检测限参考品,由阳性参考品的 RNA 稀释而成;以及 1 种基因表达最低检测限参考品,涵盖该产品所有检测基因。重复性参考品包括 2 种,分别为涵盖该产品所有检测基因的强阳性重复性参考品和弱阳性重复性参考品。基因表达最低检测限参考品和重复性参考品均由临床肿瘤组织 RNA 样品经逆转录得到 cDNA,采用数字 PCR 方法测定拷贝数后进行稀释而成。
该试剂盒同时设置了阳性对照和阴性对照,用于检测过程中试剂和仪器的质量控制。此外,每个样本均检测内参基因,用于结果的判读及评估样本的质量。
六、肿瘤组织起源基因检测试剂盒 (PCR荧光探针法)的生产工艺及反应体系研究
可帮基因对试剂盒反应体系的研究包括引物探针浓度的确定、PCR 扩增预混试剂用量的确定、dNTPs 浓度的确定、随机引物浓度的确定、逆转录酶浓度的确定等;对 PCR 反应条件的研究包括 PCR 反应程序的优化、基线阈值和阈值循环数的确定;对样本采集要求、样本保存时间、样本核酸提取方法和样本用量进行了研究。对产品检测范围内的全部癌种分别进行样本 RNA 的提取及浓度、纯度的研究,确定提取后 RNA 浓度应≥60ng/μL 且其A260/A280 应在 1.7~2.1。通过功能性实验,最终确定了最佳的反应体系。可帮基因根据试剂盒中试剂及组件的主要生产工艺的研究结果,确定了最佳的生产工艺。
七、肿瘤组织起源基因检测试剂盒 (PCR荧光探针法)的分析性能评估
该产品分析性能评估内容包括样本稳定性、准确度、分析特异性、最低检测限、精密度、包容性、干扰物质研究。
1.样本稳定性研究
可帮基因对该产品适用的福尔马林固定、石蜡包埋(FFPE)病理组织切片保存稳定性、对提取后的 RNA 样本保存条件和冻融稳定性进行了研究。确定该产品可以检测保存时间不超过 3 年 的 FFPE 样本;提取后的 RNA 样本在-70℃~-80℃保存不超过 6个月,冻融次数不超过 3 次。
2.准确度研究
可帮基因检测 28 份企业阳性参考品,检测结果分别为对应的肿瘤类型,阳性符合率 100%;检测 8 份企业阴性参考品,检测结果均为阴性,阴性符合率 100%;检测 90 份病理诊断结果明确的低分化或未分化肿瘤和转移性肿瘤临床样本,准确性为 100%。
3.分析特异性
分析特异性研究包括组织起源鉴别能力研究和交叉反应研究。可帮基因选择产品检测范围内的全部癌种的转移性肿瘤样本,使用三个批次的试剂盒对该产品的组织起源鉴别能力进行研究,检测结果显示能准确鉴别肿瘤组织及其配对癌旁组织样本的不同组织起源。可帮基因选择产品检测范围外的 8 种肿瘤组织或正常组织样本进行交叉反应研究,包括淋巴瘤、阴茎癌、骨髓瘤、胸腺癌、皮肤鳞癌、淋巴结组织、扁桃体组织、皮肤组织,结果均为阴性。
4.最低检测限研究
最低检测限研究包括各个靶基因最低检测限的研究和可检测肿瘤组织最低比例的研究。
可帮基因使用三个不同批次的试剂盒分别对产品 90 个靶基因的最低检测限进行研究,确定试剂盒对于每个靶基因最低检测限,结果显示各个靶基因的最低检测限为 5 拷贝/μL 至 50 拷贝/μL。
可帮基因使用三个不同批次的试剂盒分别对产品检测范围内的全部癌种进行研究。对每种肿瘤类型的不同肿瘤细胞比例的样本进行检测,确定可检测肿瘤组织的最低比例为肿瘤细胞比例 60%。
5.精密度
精密度研究采用三个不同批次的试剂盒,通过不同地点、人员、轮次、日间和批次对不同癌种的肿瘤临床样本进行连续 20天精密度研究,检测结果(相似度分数最大值)变异系数 CV 均不高于 15%。
对连续三批生产的试剂盒采用企业强阳性重复性参考品和弱阳性重复性参考品进行重复性检测,每批试剂盒每份参考品重复检测 10 次,每个靶基因的 Ct 值变异系数 CV 均不高于 5%。
6.包容性研究
可帮基因采用三个不同批次的试剂盒对试剂盒检测范围内的各肿瘤类型及相关亚型进行包容性确认,结果表明试剂盒对各肿瘤类型及其相关亚型均能正确检出,试剂盒包容性良好。
7.干扰物质研究
干扰物质研究分为外源性干扰物质研究和内源性干扰物质研究。
外源性干扰物研究包括针对 FFPE 样本在处理过程中的常见的酒精、福尔马林和石蜡的干扰试验研究。研究结果表明,当酒精≤1%(V/V)、福尔马林≤0.005%(V/V)、石蜡≤1%(V/V)
时,对该产品的检测结果不产生干扰。
内源性干扰物研究包括针对癌旁组织和坏死组织的干扰试验研究。研究结果表明,当待测样本中癌旁组织或坏死组织比例≤40%时,对该产品的检测结果不产生影响。
八、肿瘤组织起源基因检测试剂盒 (PCR荧光探针法)的阳性判断值研究
该产品阳性判断值的研究采用诊断信息明确的 600 例临床肿瘤样本,涵盖全部肿瘤类型。对 600 例肿瘤临床样本的最大相似度分数采用最优离散化算法确定试剂盒的相似度分数阳性判断值为 45.3。结果显示当相似度分数<45.3 时,样本的检测结果为阴性;当相似度分数≥45.3 时,样本的检测结果为阳性。当以最大相似度分数45.3作为阳性判断值,对诊断明确的临床肿瘤样本的组织起源或类型进行判定时,各肿瘤类型的阳性符合率和阴性符合率,结果如下:
九、肿瘤组织起源基因检测试剂盒 (PCR荧光探针法)的稳定性研究
可帮基因对该产品的稳定性研究包括货架效期稳定性、运输稳定性和使用稳定性(包括开瓶稳定性、冻融稳定性)。货架有效期稳定性:将三批次试剂盒置于-15℃~-25℃保存,分别于不同时间点使用企业参考品对试剂盒的性能进行检测,结果表明试剂盒在-15℃~-25℃保存条件下,产品有效期为 12 个月。此外,可帮基因对产品的运输稳定性和使用稳定性分别进行了研究。结果显示产品的性能均满足产品说明书的声称。

来源:嘉峪检测网


