您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-05-20 06:05
摘要:本文阐述了《中国药典》2020年版新增通则“生物制品病毒安全性控制”的原则和框架起草考量以及该通则的作用、地位和意义。
关键词:生物制品;病毒安全性;病毒污染;核心理念;病毒安全性评价;《中国药典》2020年版
Viral safety control of biologics
Abstract:This article describes the drafting considerations on principles and framework of the new General Requirement “viral safety control of biologics” in the Chinese Pharmacopoeia 2020, as well as the role, status and significance of the General Requirement.
Key words: biotechnology or biological products; viral safety; viral contamination; core concept; viral safety evaluation; Chinese Pharmacopoeia 2020
生物制品来源多涉及活的生物体,制备过程使用的各种原辅材料亦来源复杂,且制品组分一般不能采用苛刻的终端理化处理。这些特殊性使外源因子特别是潜在的病毒污染成为生物制品质量控制中的挑战[1]。近年来,人与自然环境相互作用愈加密切,动物病毒向人类溢出的风险日益严峻,重大公共卫生威胁事件时有发生[2-5],SARSCoV2大流行疫情更是成为人类历史上最严重的公共卫生威胁[6]。这种背景下,业界和公众对病毒安全性关注越来越高。生物制品存在较高的病毒污染潜在风险,曾报道多种生物制品制备过程中出现病毒污染事件[7-10],这种污染风险即使未产生临床上的严重后果,但对于药物的供应特别是罕见病药物的供应,影响巨大[11],还可能危及相应生物制品的工艺以及厂区其他产品的质量和安全,公众对生物技术产业的信心也会受到损害。随着生物技术的蓬勃发展,生物制品使用人群不断扩大,多种有治疗前景的新兴疗法推向临床应用,新的工艺理念和方法不断涌现[12],因此,生物制品的病毒安全性控制需要不断改进和完善[13-14]。另外,现今的检测技术在“快、准、全”的理念指导下呈现快速发展[15-16],对于新技术特别是基于核酸检测技术的成熟应用,外源因子得到更加方便快捷的识别,在很大程度上推动新的理念发展[17-19]。生物制品申请临床、上市以及上市后病毒安全性控制评估的需求也日益增加[20]。所有这些新的认识和新的技术发展也在一定程度上促进/推动新的生物制品病毒安全性控制法规出台。目前,国际上欧美日以及人用药品注册技术要求协调会(ICH)对生物制品病毒安全性均具有或正在更新相关技术要求[13, 21-23],我国药典起草病毒安全性控制的技术标准和要求十分必要,对于保证药品的安全和有效生产具有重要的意义。
1 生物制品病毒安全性控制法规的基本理念及发展
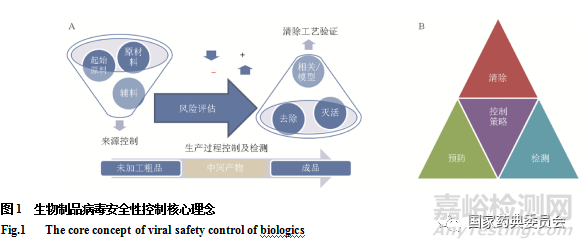
20世纪,一些疫苗产品在生产过程中发生有害病毒污染(如脊髓灰质炎病毒疫苗的SV40污染),相当长一段时间内其对人群健康的影响不完全清楚;20世纪80年代初,血液制品曾遭到诸如人类免疫缺陷病毒(HIV)等经血源传播病毒的污染而导致接受污染制品治疗的患者感染。这些病毒安全性风险导致公众对行业安全生产的能力产生怀疑[10]。从那时起,治疗性蛋白类制品的研发生产逐步转向对病毒安全可控性较强的重组DNA技术。但重组细胞的培养也同样易受到外源性因子的污染。为了确保血液制品、疫苗和重组产品等的病毒安全性,世界各国际组织及ICH和国家监管机构制定并实施了尽可能杜绝病毒污染风险的安全策略,发布了一系列指导原则/药典要求[1,14,22-23]。虽然各法规之间存在适用范围和具体表述的差异,但其核心理念高度一致。也是本版药典通则“生物制品病毒安全性控制”所需遵循的核心理念[1]:在风险评估的基础上,进行原材料/基质的来源控制、生产过程中适当阶段产品测试(包括纯化前、中间材料、以及成品阶段)及病毒清除工艺评估/验证。生物制品病毒安全性控制以风险评估为基础,进行来源控制,生产过程控制及检测,以及清除工艺评估/验证(图1A)。
过去的经验教训,促成了目前病毒安全性控制的最佳实践,这依赖于病毒安全性控制策略,评估和降低病毒污染风险的三条互补的原则:预防(来源控制:选择合适的起始材料和原材料,使其最大限度控制外来病毒的风险)、检测(生产过程中适当步骤产品的测试,以确认它们没有可检测的病毒)、清除(病毒清除工艺的评估:在制备工艺中,加入去除和灭活潜在内/外源性病毒的步骤,以确保产品无污染可感染的潜在内外源病毒)(图1B)。通过理念指导下的实践,保障了多种生物制品数十年年的安全使用,使用重组DNA技术生产的治疗性蛋白至今没有出现将污染病毒传播给患者的案例,保持着优良的病毒安全记录[10]。
国内外各技术要求或指导原则具有较高的科学性、规范性及严谨性,特别是ICH Q5A,但也存在适用范围窄,框架不够简明,核心理念不突出等问题。对于扩大范围的生物制品,亦缺少明确统一的参考指南,即使是相对品种适用范围较宽的日本药典收载的指南,也未将血液制品和疫苗等制品的病毒安全性控制纳入其中,更不论有治疗前景的新兴疗法所涉的制品/制剂[21,23]。另外,近年来生物技术、检测技术、工艺理念等方面均进展迅速,已有的技术要求或指导原则对于一些新的技术和理念,如新型细胞基质、新兴分析技术(下一代测序技术,NGS)、新型工艺理念(连续制造,通用制备工艺/模块化工艺步骤病毒验证,病毒样颗粒替代病毒)等,缺乏支持或不能有效适用已有的相应指南/规范[1,24-25]。这就要求我们更新病毒安全性控制理念,与时俱进,在新的理念要求下,根据实际情况实施安全性控制措施,最终保障稳健地生产安全的高质量产品。
2 通则“生物制品病毒安全性控制”遵循的基本原则
美国、欧盟、日本均将病毒安全性控制内容纳入到相应药典。《中华人民共和国药典》(简称《中国药典》)2020年版之前尚无系统的、通用的病毒安全性控制技术要求。鉴于《中国药典》在我国医药行业的法定权威地位,结合生物制品病毒安全性控制核心理念及理念发展趋势。2020年版药典建立和收载能适应研究、生产、监管要求的病毒安全性控制原则势在必行。
2.1 风险评估原则
生物制品的一个共同特点是存在病毒污染的风险性,这种污染在临床上可产生严重的后果。污染可来自起始原材料本身,也可来自生产过程中偶然带入的外源病毒。对于潜在的病毒污染源,首先应根据可能的污染风险进行风险评估。通过风险评估,可以达到早期预防早期发现及采取措施的目的。
综合生物制品病毒安全性控制主要的法规要求,病毒安全性控制的核心理念亦建立在风险评估的基础上[1]。不同类型的生物制品在来源、潜在污染病毒的特性、制备工艺等方面的不同,导致其病毒安全性风险大小存在差异,对于潜在的病毒污染源和可能的污染途径,进行风险剖析及评估,找出风险点,以便根据评估结果实施病毒安全性控制策略。依据控制策略实施生物制品病毒安全性控制的措施,可以为制品的病毒安全性架起多道防线,最终确保生物制品的病毒安全性底线。强调风险评估的重要性,也是针对不同品种品类生物制品的病毒安全性,采取不同的具体措施来架设防线,做到安全和资源的平衡。
尽管生物制品病毒污染会造成破坏性后果,但有效地从以前的污染事件中吸取教训仍然是一项挑战。通过风险评估的理念进行风险识别、风险评价以及相应的风险降低措施实施,可以应对这一挑战。因此,生物制品的病毒安全性控制要求,应建立在风险评估的基础上结合产品特点综合考虑。
2.2 全过程控制原则
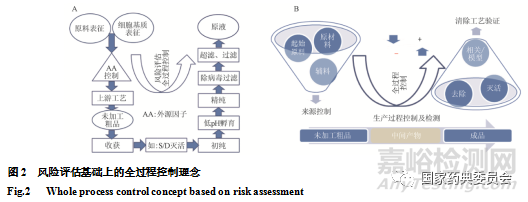
生物制品病毒安全性控制核心理念中“原材料/基质的来源控制、生产过程中适当阶段产品测试(包括纯化前、中间材料、以及成品阶段)及病毒清除工艺评估”涉及产品生产的全过程,可使用外源性因子综合控制策略(图2 A)将病毒安全性控制纳入产品制备的全过程[1,26],和毒性物质或微生物等质量控制异曲同工。根据风险评估的结果,在产品生产的全过程中的风险点进行必要的干预,实施最佳实践(预防/检测/清除)(图1 B, 2A),便形成了病毒安全性控制的全过程控制原则(图2 B)。其中潜在病毒污染的源头控制是关键点,如何从源头上进行有效控制事关病毒安全性控制的成败。对于潜在病毒污染可能来源的风险点应逐层把控,特别体现在起始原材料的控制上。
生物制品病毒安全性控制应体现在生物制品质量控制的全过程。其基本要素包括对生产过程使用的相关物料(起始原材料、原材料和辅料)的来源控制、病毒污染筛查或处理,生产工艺对病毒的清除作用,以及对产品(包括中间产物和成品)病毒污染的检测(图2B)。
2.3 全生命周期管理原则
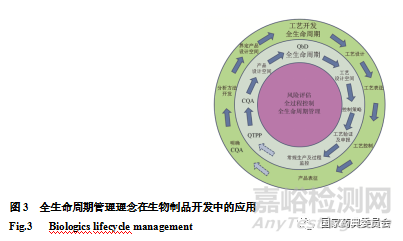
生物制品质量源于设计(QbD)的理念强调从预期的质量目标开始,强调产品和工艺的理解及工艺控制,通过识别对产品安全性和/或有效性具有重要意义的产品属性(QTPP)和关键质量属性(CQA),交付这些属性的工艺设计;然后将质量风险管理结合到对药品和工艺的深刻理解中,建立适当的控制策略,通过验证以确保控制策略的有效性并持续监控,从而确保产品生命周期内的稳健工艺性能,并促进产品生命周期内的持续改进[27]。所以风险评估、全过程控制以及全生命周期的理念环环相扣,共同持续保障产品质量(图3)。通过贯彻全生命周期管理的理念,可以进一步保障生物制品病毒安全性控制的持续有效性。
全生命周期管理理念贯彻于病毒安全性控制始终,工艺变更对病毒清除的影响应加以评估,根据影响程度,对病毒清除步骤进行必要的确认或再验证。必要时还应通过上市后监测追溯产品病毒安全性,保证生物制品全生命周期的病毒安全性。毕竟,在生物制品本身安全性风险客观存在的情况下,所谓安全均是相对的[28]。这也说明了生物制品的全生命周期管理的理念(图3)对于生物制品的病毒安全性控制至关重要贯穿始终。
2.4 生物制品病毒安全性控制核心理念小结
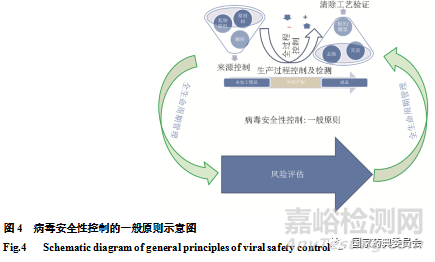
以生物制品病毒安全性控制核心理念为基础[1],经多个类别生物制品进行适用性确认,结合全生命周期管理的理念[27,29-33],以及和国内外产品品种实际情况,我们进一步对生物制品病毒安全性核心理念进行了精炼升华。最终本版药典收载的通则“生物制品病毒安全性控制”形成了代表生物制品病毒安全性控制的科学理念和发展趋势的最基本原则:“风险评估、全过程控制以及全生命周期管理”(图4),其具有生物制品品种品类的广泛适用性,其中风险评估是基础,全过程控制是手段,全生命周期管理是持续保障,赋予了控制原则与时俱进、整体考量的科学内涵。
3 生物制品病毒安全性控制的框架结构
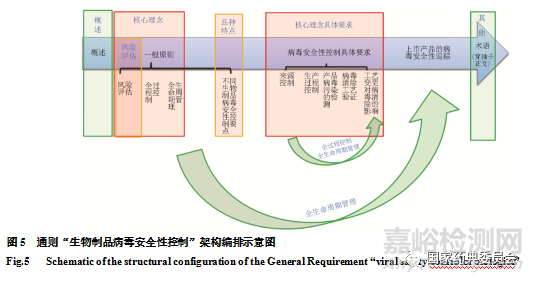
“生物制品病毒安全性控制”通则规范于药典体例。前言部分明确限定适用范围和控制对象;该标准全文贯穿于风险评估原则、全过程控制原则和全生命周期管理原则的核心理念,详细分述病毒安全性控制的般原则、病毒安全性控制的具体要求和上市产品的病毒安全性追踪三大内容(见图5)。阐明了收载本标准的目的意义,具体品类的关注重点、执行原则和操作标准。该标准条理清晰,要求明确,查阅方便,术语解释正确不产生歧义。
生物制品本身具有品类多,性质差异大的特点。尤其近年来,随着新技术的发展,先进治疗性医药产品(Advanced Therapy Medicinal Products)呈爆发式增长,其选材及制备过程涉及到一些特定的风险因子,这些特殊性是由原始材料、产品/产物特点和生产工艺的性质所决定,其病毒安全性控制需要采取一些额外的特殊的措施来保证。通则起草编撰时考虑到其需要适用更广适用范围,但中国药典中收载的品种特性差异大,因此既需要符合统一适用性要求的广度,又能应对特定品种的差异化需求。所以该通则在普适原则的指导下,将具有相似特点的品种品类病毒安全性控制的侧重点分别予以明确,体现出生物制品病毒安全性控制的品类特点,达到个别与一般,个性与共性的统一(图5)。
4 讨论
《中国药典》2020年版生物制品病毒安全性控制的起草编撰,以风险评估、全过程控制和全生命周期管理的核心理念为基础,并将核心理念与发展趋势相结合。制定收载的本通则适用于药典三部收载的全部生物制品定义之范围,包括人血液制品,动物体液/组织来源制品、疫苗、重组治疗性生物制品、基因治疗产品等;同时本通则还将药典已收载于凡例、总论、通则、指导原则及各论中相关生物制品的病毒安全性控制所设立的项目、目的、要求、标准、和检测方法系统化;本通则强调了生物制品的病毒安全性控制贯穿于风险评估、全过程控制和全生命周期管理的核心理念。
4.1 更完善的理念
通过国内外病毒安全性控制的各相关法规、规定及指导原则,各国药典标准以及专业文献等资料进行广度和深度的比对、分析、归纳、提炼,完善了生物制品病毒安全性控制的核心点,形成了本版药典通则生物制品病毒安全性控制的“核心理念”,将该核心理念与发展趋势及所控品种(人血液制品、动物体液/组织来源制品、疫苗、重组治疗性生物制品、基因治疗产品等)的风险特性相结合,进行“适应症”外展,形成了对病毒安全性控制覆盖品种最广,适用性较好的药典标准。
4.2 更广泛的适用性
本通则将一般原则和具体品种实际相结合,综合品种的应用安全性历史、病毒风险性评估情况等进行通则制定,以风险评估为基础,做到了一般原则与品种差异的统一。基于风险进行全生命周期的考量,降低品种病毒污染风险,对当前生物制品的安全和有效生产具有重要意义,对有治疗前景的新兴疗法亦有参考作用。
4.3 适度的前瞻性
生物制品(人血液制品、动物体液/组织来源制品、疫苗、重组治疗性生物制品、基因治疗产品)品种差异大,风险大小不一。本通则既强调一般原则,又兼顾品种差异,总体体例简洁明了[34]。
本通则结合质量风险管理及生命周期管理理念等质控理念的发展趋势,归纳了病毒安全性控制的共性(“一般原则”),体现了品种差异化(对不同类别产品风险控制的重点进行有侧重地描述),拓展了适用范围。基于风险和生命周期,既有针对已知风险的控制策略,也有针对未知风险的控制措施;还包括了上市后跟踪和变更后的再评价。在总体技术要求上,与当前美国、欧盟、日本、ICH等相关标准一致。先进制造工艺,如连续制造、分布式制造、人工智能辅助等技术的快速发展促进药物制造现代化[12],需要在更早和更广的范围内考虑法规对于新技术的适用性,该通则对当前生物制品的安全和有效生产具有重要意义,对有治疗前景的新兴疗法亦有参考作用。但需要强调的是,任何技术或者措施只是手段,使用的措施或者提供的数据着眼点是支持低病毒安全性风险,我们的最终目的是要全面了解产品的病毒安全风险,保障产品病毒相关的安全性。
参考文献
[1] 郭怀祖,杨美花,杨汇川,等.生物制品病毒安全性控制的核心理念探讨[J].中国新药杂志,2020,29(24):2781
GUO HZ, YANG MH, YANG HC, et al. Discussion on the core concept for viral safety of biological products[J].Chin J New Drugs,2020,29(24):2781
[2] DE GROOT RJ, BAKER SC, BARIC RS, et al. Commentary: Middle east respiratory syndrome coronavirus (merscov): announcement of the coronavirus study group[J]. J Virol, 2013, 87(14): 7790
[3] ZAKI AM, VAN BOHEEMEN S, BESTEBROER TM, et al. Isolation of a novel coronavirus from a man with pneumonia in Saudi Arabia[J]. N Engl J Med, 2012, 367:1814
[4] LU R, ZHAO X, LI J, et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding[J]. Lancet, 2020, 395(10224): 565
[5] Middle East respiratory syndrome coronavirus (MERSCoV). WHO[EB/OL]. (20190311) [20191101]. https://www.who.int/newsroom/factsheets/detail/middleeastrespiratorysyndromecoronavirus(merscov).
[6] World Health Organization. Clinical management of severe acute respiratory infection when novel coronavirus (nCoV) infection is suspected: interim guidance, 25 January 2020[R]. World Health Organization, 2020.
[7] Fletcher, Tom, and Holden Harris. Safety Drives Innovation in AnimalComponentFree CellCulture Media Technology [EB/OL]. (20160914) [20171214]. http://www.processdevelopmentforum.com/articles/safetydrivesinnovationinanimal componentfreecellculturemediatechnology/
[8] KERR A, NIMS R. Adventitious Viruses Detected in Biopharmaceutical Bulk Harvest Samples over a 10 Year Period[J]. PDAJ Pharm SciTechnol, 2010, 64(5):481
[9] 陈琪, 张旻, 杨滨,等. 细胞培养生物制品在不同研发阶段病毒清除的要求[J]. 中国新药杂志, 2014,23(8):962
CHEN Q, ZHANG M, YANG B, et al. Viral clearance requirement for cellline derived biologicsat different stages of development[J].Chin J New Drugs, 2014,23(8):962
[10] BARONE PW, WIEBE ME, LEUNG JC, et al. Viral contamination in biologic manufacture and implications for emerging therapies[J]. Nat Biotechnol, 2020, 38(5): 563
[11] Zachary Brennan, Genzyme offers inside look at Massachusetts plant under consent decree[EB/OL],2014 https://www.biopharmareporter.com/Article/2014/06/25/GenzymeoffersinsidelookatMassachusettsplantunderconsentdecree
[12] National Academies of Sciences, Engineering, and Medicine. Innovations in Manufacturing Drug Products[M]//Innovations in Pharmaceutical Manufacturing on the Horizon: Technical Challenges, Regulatory Issues, and Recommendations. National Academies Press (US), 2021
[13] CDE,生物组织提取制品和真核细胞表达制品的病毒安全性评价技术审评一般原则[S]. 2005(12):GPH31
CDE,General Rules for Technical Review and Evaluation of Viral Safety Evaluation of BiologicalTissue Extraction Products and Eukaryotic Expression Products[S]. 2005(12):GPH31
[14] 李敏, 郭秀侠, 刘伯宁. 关于生物制品工艺验证的审评实践与思考[J]. 中国生物制品学杂志, 2017, 30(6):664
LI M, GUO XX, LIU BN. Discussion on general principle and key points of process validation for biologics[J].Chin J Biol, 2017, 30(6): 664
[15] LIU T, GUO H, ZHU L, et al. Fast characterization of Fccontaining proteins by middledown mass spectrometry following IdeS digestion[J]. Chromatographia, 2016, 79(21): 1491
[16] 汪泓, 徐进, 尹红锐, 等. 多属性分析方法应用于治疗类抗体药物质量控制的考量与前景[J]. 药学学报, 2020, 55(9): 2092
WANG H, XU J, YIN HR, et al. Prospects and current use of the multiattribute method for quality control of therapeutic antibodies[J]. Acta Pharm Sin, 2020, 55(9): 2092
[17] KHAN A S, NGSHS, VANDEPUTTE O, et al. A multicenter study to evaluate the performance of highthroughput sequencing for virus detection[J]. Msphere, 2017, 2(5):e00307
[18] WHO/BS/2020.2394 Proposed 1st International Virus Reference Standards for Adventitious Virus Detection in Biological Products by NextGeneration Sequencing (NGS) Technologies (CBER5),[EB/OL].https://www.who.int/publications/m/ item/WHOBS20202394
[19] CLEVELAND MH, ANEKELLA B, BREWER M, et al. Report of the 2019 NISTFDA workshop on standards for next generation sequencing detection of viral adventitious agents in biologics and biomanufacturing[J]. Biologicals, 2020;64:76
[20] 刘伯宁, 罗建辉. 关于创新型抗体药物药学评价的思考[J]. 药学学报, 2017,52(12):1811
LIU BN, LUO JH. Research and development of innovative antibodybased drugs[J]. Acta Pharm Sin, 2017, 52(12): 1811
[21] Guideline, ICH Harmonised Tripartite. viral safety evaluation of biotechnology products derived from cell lines of human or animal origin Q5A (R1)[S]. Current Step 4 (1999)
[22] 国家药品监督管理局.血液制品去除/灭活病毒技术方法及验证指导原则[S].2002
NMPA, Technical Methods for Viral Removal/Inactivation of Blood Products, and Technical Guide lines for their Validation[S].2002
[23] JP XVII[S].2016:2435
[24] 赛文博,于鹏丽,李小静,等.重组表达生物制品生产中病毒清除验证策略研究进展[J].中国新药杂志,2021,30(10):876
SAI WB, YU P, LI XJ, et al. Research progress in viral clearance validation strategy of recombinant biological products[J].Chin J New Drugs, 2021,30(10):876
[25] JOHNSON SA, BROWN MR, LUTE SC, et al. Adapting viral safety assurance strategies to continuous processing of biological products[J]. Biotechnol Bioengin, 2017, 114(1): 21
[26] ROUSH DJ. Integrated viral clearance strategies—reflecting on the present, projecting to the future[J]. Curr Opin Biotechnol, 2018, 53: 137
[27] RATHOREAS. Quality by design (QbD)based process development for purification of a biotherapeutic[J]. Tren Biotechnol, 2016, 34(5): 358
[28] KAISER J. Virus used in gene therapies may pose cancer risk, dog study hints[J]. Science, 2020,1:6
[29] Guideline, ICH Harmonised Tripartite. Pharmaceutical Development Q8(R2)[S]. 2009
[30] Guideline, ICH Harmonised Tripartite. Quality Risk Management Q9 (R1)[S]. 2005:Current Step 4
[31] Guideline, ICH Harmonised Tripartite. Pharmaceutical Quality System Q10[S]. 2008:Current Step 4
[32] Parenteral Drug Association, Technical Report No. 56 (Revised 2016),Application of PhaseAppropriate Quality Systems and CGMP to the Developmentof Therapeutic Protein Drug Substance[S].2016
[33] RATHORE AS. Roadmap for implementation of quality by design (QbD) for biotechnology products[J]. Trends Biotechnol, 2009, 27(9):546
[34] Derrick Gingery, Pink Sheet‘Just Say It!′-New Streamlined Guidance Format Coming, FDA′s Woodcock Says[EB/OL]. (20171114) [20180809]. https://pink. pharmaintelligence. informa. com/PS121965/JustSayItNewStreamlined GuidanceFormatComingFDAsWoodcockSays
《中国药品标准》杂志 2022年第23卷第2期 ,郭怀祖1, 杨美花2, 杨汇川3, 公雪杰4, 侯盛5, 张华捷6,李长清7, 董关木6, 李敏8, 孟淑芳6, 侯继锋6, 郭中平9
(1.抗体药物与靶向治疗国家重点实验室,国家药品监督管理局治疗类单抗质量控制重点实验室,上海张江生物技术有限公司,上海 201203; 2.厦门特宝生物工程股份有限公司,福建 厦门 361028;3.中国生物技术股份有限公司,北京 100029; 4.北京科兴生物制品有限公司,北京 100085;5.上海百迈博制药有限公司,上海 201203; 6.中国食品药品检定研究院,北京 100820;7.中国医学科学院输血研究所,成都 610052; 8.国家药品监督管理局药品审评中心,北京 100022;9.国家药典委员会,北京 100061)

来源:《中国药品标准》杂志


