您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-03-01 11:20
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.嘉和TNF-α单抗获批上市。嘉和生物注射用英夫利西单抗(GB242)获NMPA批准上市。英夫利西单抗是一种抗肿瘤坏死因子(TNF-a)单克隆抗体,由强生开发,原研产品类克已于2006年获批进口中国,用于治疗溃疡性结肠炎、克罗恩病、活动性类风湿关节炎、活动性强直性脊柱炎、斑块型银屑病等等。GB242能够以低剂量结合TNF-α,从而抑制人体对TNF-α的自然反应并改善炎症反应及自身免疫性疾病。
2.药明CD19-CAR-T新适应症报产。NMPA受理药明巨诺靶向CD19的自体嵌合抗原受体T(CAR-T)细胞免疫治疗产品倍诺达® (瑞基奥仑赛注射液)用于治疗复发或难治性(r/r)滤泡淋巴瘤(FL)患者的第二项适应症上市许可申请。2020年9月,NMPA已将倍诺达®治疗r/r FL纳入突破性治疗品种。一项公布于ASH2021年会上用于治疗r/r B细胞非霍奇金淋巴瘤的RELIANCE研究B队列数据显示,倍诺达®治疗3个月时,最佳完全缓解率和客观缓解率分别达到92.6%和100%。
3.和铂B7-H4/4-1BB双抗将上I期临床。和铂医药宣布机构审查委员会IRB已批准其B7H4/4-1BB双抗HBM7008在澳大利亚开展I期临床,评估HBM7008用于实体瘤患者的安全性、耐受性、药代动力学、药效动力学和初步抗肿瘤活性。HBM7008同时靶向肿瘤抗原B7H4和T细胞共刺激分子4-1BB,其仅在与B7H4结合时,特异性激活T细胞,产生抗肿瘤活性。4-1BB的Crosslinking依赖性激活受B7-H4结合的调节,从而更好地平衡了安全性和有效性。
4.百济神州发布2021年业绩报告。2月25日,百济神州公布2021年第四季度及全年业绩快报。2021年第四季度收入为2.14亿美元,全年收入为12亿美元。2021第四季度产品收入达1.968亿美元,相较上一年同期1.001亿美元,增长96.6%;全年产品收入达6.340亿美元,相较上一年3.089亿美元,增长105.3%。2021年第四季度和全年的百泽安®在中国的销售额分别为5,440万美元(-14%)和2.551亿美元(+56%)。
5.华东医药1.05亿欧元入股德国Heidelberg。华东医药发布公告宣布,全资子公司华东医药投资公司与德国Heidelberg公司签署股权投资协议(1.05亿欧元),最终取得Heidelberg共计35%的股权,成为其第二大股东;华东医药旗下中美华东公司与Heidelberg 达成产品合作协议,获得Heidelberg在研产品HDP-101和HDP-103在中国大陆、香港等20个亚洲国家和地区的独家开发及商业化权益,以及另外2款在研产品HDP-102、HDP-104的独家选择权。
国际药讯
1.全球首款植源性新冠疫苗获批上市。加拿大卫生部批准葛兰素史克与Medicago公司开发的新冠疫苗Covifenz上市,用于18-64岁人群接种以预防由SARS-CoV-2引起的新冠肺炎。Covifenz采用植物的冠状病毒样颗粒(CoVLP)技术,由表达为病毒样颗粒(VLP)的重组棘状(S)糖蛋白组成,并与GSK大流行佐剂共同施用。这是全球首款植物源性新冠疫苗的首个监管批准。在全球Ⅲ期临床中,Covifenz对SARS-COV-2所有变异株(Omicron除外)的总体疫苗效力为71%。
2.CHMP推荐批准Kimmtrak治疗mUM。欧洲药品管理局(EMA)人用医药产品委员会(CHMP)推荐批准Immunocore公司TCR疗法Kimmtrak(tebentafusp-tebn,IMCgp100)上市,用于治疗HLA-A*02:01阳性、不可切除性或转移性葡萄膜黑色素瘤(mUM)。在一项Ⅲ期临床中,Kimmtrak治疗使这类患者的死亡风险降低49%(HR=0.51,p<0.0001),中位OS近22个月。Kimmtrak是全球首个获批的TCR疗法,已于今年1月获FDA批准上市,是FDA批准用于mUM的首款疗法。
3.渐冻症复方疗法申报欧洲上市。Amylyx Pharma复方制剂AMX0035(苯丁酸钠/牛磺酸二醇)的上市申请获欧洲药品管理局(EMA)受理,用于治疗肌萎缩侧索硬化症(ALS,俗称“渐冻症”)。一项Ⅱ期CENTAUR试验3年随访数据显示,AMX0035使患者死亡风险降低44%(HR=0.56;95%CI:0.34-0.92);并提高患者的总生存期(中位OS:25.0个月VS.18.5个月)。目前,AMX0035正在接受加拿大和美国的监管审查。FDA此前已授予AMX0035优先审查,PDUFA日期为2022年6月29日。
4.肌肉减少症候选疗法步入临床。Oncocross公司AI驱动的肌肉减少症候选药物OC514启动一项全球性Ⅰ期临床试验。Oncocross致力于利用其基于转录组数据的AI药物发现平台RAPTOR AI发现创新疗法,已有药物的新适应症,以及新药物组合的适应症。在各种动物模型中,OC514已显示出对年龄相关的肌肉减少症,以及肌萎缩侧索硬化(ALS),杜氏肌营养不良等罕见疾病的治疗潜力。OC514有望成为全球研发进展最快的AI药物之一。
5.Veru联合礼来开展乳腺癌Ⅲ期临床。Veru公司口服选择性雄激素受体(AR)靶向激动剂enobosarm将联合礼来CD4/6抑制剂Verzenio开展一项Ⅲ期临床ENABLAR-2试验,评估联合用药用于二线治疗AR+ER+HER2-转移性乳腺癌的有效性与安全性。该试验预计将于2022年第一季度启动。enobosarm已在2项用于治疗AR+ER+HER2-转移性乳腺癌的Ⅱ期临床中,显示出具有临床意义的客观肿瘤缓解、生活质量改善、良好安全性。
6.Biohaven公司引进BMS临床后期SMA新药。Biohaven公司与百时美施贵宝(BMS)就后者一款临床后期脊髓性肌萎缩症(SMA)新药taldefgrobep alfa(BMS-986089)达成全球开发和商业化许可协议。Taldefgrobep是Biohaven公司第三个获得百时美施贵宝授权的在研项目,它属于一类名为adnectin的类抗体药物,旨在与肌肉生长抑制素特异性结合。该新药针对脊髓性肌萎缩症(SMA)患者的Ⅲ期临床预计今年启动。
医药热点
1.同济医院罕见病多学科门诊正式开诊。每年2月的最后一天是“国际罕见病日”,2月28日,同济医院罕见病多学科门诊(MDT)正式开诊预约。罕见病MDT团队由同济医院儿童遗传代谢专科、心血管内科、血液内科等40余个专科的50位医生组成,汇集了罕见病相关专业领域权威专家,为患者提供“组团式”会诊服务,让患者一次就医,就能获得来自不同学科多位专家的联合诊疗。
2.重庆240余家医院实施医保支付方式改革。重庆市卫健委日前在新闻发布会上宣布,重庆市将按照国家医保DRG/DIP支付方式改革三年行动计划要求,年内将40%的二级及以上医疗机构(240余家)纳入改革范围。从已实现按DRG付费的陆军特色医学中心、重医附二院等4家医疗机构来看,去年12月,患者住院次均自付费用同比降低261.77元,同比下降4.93%,个人负担减轻。
3.华西医疗团队研发出居家可用的核酸检测仪。四川大学华西医院胡文闯教授研发团队通过多学科交叉合作,研发出一款一次性、便携式、快捷的核酸检测试剂仪器。这款核酸检测仪大小如同打火机一般,市民在家就可以自己开展核酸检测,检测后40分钟之内就能够出结果。这款核酸检测试剂仪器预计将于2022年上半年正式面市。
评审动态
1. CDE新药受理情况(02月28日)
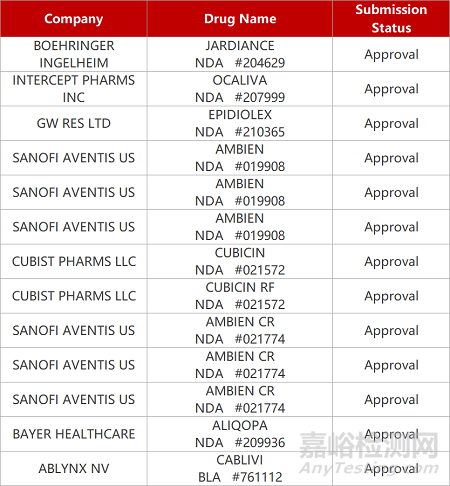
2. FDA新药获批情况(北美02月24日)

来源:药研发


