您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-12-23 20:23
本文梳理总结了我国化学药品和生物制品药学申报资料格式实施 ICH M4Q 指导原则的经验,同时结合 M4Q ( R1) 版本实施后 ICH 发布的多项质量和综合性技术指导原则,就药学申报资料遵循通用技术文档( CTD) 格式的具体技术要求和主要问题进行了探讨。
《M4: 人用药物注册申请通用技术文档( com-mon technical documents,CTD) 》是药品注册申报资料技术文档的一种通用格式,由国际人用药品注册技术要求协调会( ICH) 于 2000 年 11 月正式发布实施。该指南的协调制定主要是为了节约申请人在不同国家地区进行药品注册申报时整理编纂申报资料所需的时间和资源( 包括电子文档) ,同时引导良好的技术审评规范,提高监管机构与申请人之间、不同监管机构之间的交流效率。其适用范围为新药申报上市的注册申请,包括新化学实体的化学药品和生物技术产品。
作为 ICH 的二级指导原则之一,ICH M4 自2001 年起陆续在美国、欧洲、日本等实施。我国原国家食品药品监督管理总局( 简称“原总局”) 于2017 年 6 月正式加入 ICH,并规定自 2018 年 2 月 1日起化学药品注册分类 1 类、5.1 类、治疗用生物制品 1 类及预防用生物制品 1 类注册申请适用《M4:人用药物注册申请通用技术文档( CTD) 》[1] ,其中包括《M4( R4) : 人用药物注册通用技术文档的组织》、《人用药物注册通用技术文档: 行政管理信息》、《M4Q( R1) : 人用药物注册通用技术文档: 药学部分》、《M4S( R2) : 人用药物注册通用技术文档: 安全性部分》和《M4E( R2) : 人用药物注册通用技术文档: 有效性部分》。
作为新的《药品注册管理办法》配套文件之一,2020 年 6 月 30 日,国家药品监督管理局发布了《国家药监局关于发布生物制品注册分类及申报资料要求的通告》( 2020 年第 43 号)[2] 和《国家药监局关于发布化学药品注册分类及申报资料要求的通告》( 2020 年第 44 号)[3] ,明确自 2020 年 10 月 1 日起,药物临床试验、药品上市注册及化学原料药的申请、预防用生物制品和治疗用生物制品临床试验申请及上市注册申请,应当按照《M4: 人用药物注册申请通用技术文档( CTD) 》格式编号及项目顺序整理并提交申报资料。
本文梳理总结了我国化学药品和生物制品药学申报资料实施 CTD 格式的经验,并结合 ICH 近年新发布的各项技术指导原则,就药学申报资料遵循CTD 格式的具体技术要求和主要问题进行了探讨,旨在帮助申请人进一步提高申报资料的撰写质量。
一、ICH M4Q 在我国实施的背景
对于化学药品,2007 年起实施的原《药品注册管理办法》( 简称 2007 版法规) 附件 2 中简要规定了不同注册分类的化学药品所需提交的申报资料要求。为了加强质量控制体系的综合理念、进一步引导我国研发水平的提升、加快与国际接轨,2010 年 9月原总局发布了《关于按 CTD 格式撰写化学药品注册申报资料有关事项的通知》( 国食药监注[2010]387 号) ,主要目的在于引导和鼓励原化药注册分类3,4,5,6 类的生产注册申请参照 CTD 格式的要求整理和提交药学申报资料。2016 年随着化学药品注册分类的改革以及对 eCTD 实施的展望,原总局发布了《总局关于发布化学药品新注册分类申报资料要求( 试行) 的通告》( 2016 年第 80 号)[4] ,规定化学药品所有注册分类的上市申请均应参照 CTD 格式提交申报资料。
对于生物制品,2007 版法规附件 3 中简要规定了不同注册分类的生物制品所需提交的申报资料要求。自2018 年2 月1 日正式实施 ICH M4 指导原则之后,国内外治疗类和预防类 1 类生物制品均按照CTD 格式进行申报,其他类别大多数申请则仍按照2007 版法规要求进行申报。在 2018 第 10 号公告发布之前生物制品并无实施 CTD 的基础。为更好地推动 M4 指导原则在我国的实施,ICH 中国办公室开展了一系列 ICH M4 相关培训,对欧盟、美国及日本实施情况进行了梳理,制定了我国的实施路径。
需指出的是,我国在 2018 年之前发布的化药CTD 格式与 2018 年 2 月 1 日正式实施的 ICH M4Q保持了较好的一致性,但对其中的模块进行了较小的调整,如: 将 3.2.P.4 辅料的控制调整为原辅料的控制; 将 3.2.P.7 调整为稳定性,而将原包装系统信息合并入 3.2.P.2.4 等。这些调整主要是为了适应当时我国对原辅包的管理要求,仅对部分涉及原辅包的模块位置进行了合并,实际未影响具体的申报资料要求。随着原辅包监管制度的改革,现阶段无需再进行上述调整,申请人应完全参照 CTD 格式进行申报。
二、ICH M4Q 在我国实施的总体考虑
M4Q 是药学部分申报资料的格式规定,其按照质量控制体系的思路,固定了申报资料中原料药和制剂部分的结构框架,在各章节项下对具体研究内容未做明确阐述,而是指明应参见相关的指导原则。M4Q 目前执行的是 2002 年发布的 M4Q( R1) 版本,距现在已有近 20 年的时间。在这期间 ICH 陆续发布了多个质量( Q) 和综合( M) 系列的技术指导原则,对于原料药和制剂的开发、控制策略等均提出了一系列新的技术要求。因此 M4Q 实施所面临的主要问题和挑战在于现行版本制定的较早,针对后续ICH 发布的各项技术指导原则所涉及内容尚未进行统一的格式协调和规定,导致当前部分申报资料存在信息缺失、信息放置位置错误等问题。申请人需要结合现行药学研究技术要求开展药品的研发工作,在此基础上进行信息、数据的整理和归纳,保证申报资料撰写的科学性、逻辑性和合理性。
三、重点关注内容
结合各项培训和申报期间的相关沟通交流,ICH M4Q 自实施以来已积累了一定经验,但目前申报资料仍然存在完整性、规范性、合理性等问题。结合新发布的技术指导原则,需重点关注以下几个方面。
3.1 制剂的产品开发
M4Q( R1) 中所体现的制剂产品开发相关信息是基于传统型( traditional) 方法开展研究所得到的,强调的是采用经验证的、确定的工艺参数来保证生产工艺的重现性和稳健性。而随着制药技术的不断发展,质量源于设计( QbD) 理念的不断成熟,对于如何设计出一个高质量的产品,以及能持续生产出符合预期质量水平产品的生产工艺,已逐步取代了早年“质量源于检验”、“质量源于生产”的认识。
在 M4Q( R1) 的 3.2.P.2 产品开发章节中未明确相关的参考指导原则,申报资料要求也较为简略。这部分内容后续于 2004 年 11 月发布的 ICH Q8 药品研发指导原则中进行了详细阐述( 目前执行 2009年 8 月生效的 R2 版本)[5] 。该指南分为 2 个部分,第一部分详细说明了 3.2.P.2 产品开发各个章节的申报资料要求; 第二部分对 Q8 核心部分的重要概念做了进一步的解释,并首次引入了 QbD 的基本原则。因此,在准备制剂申报资料时需重点关注。
3.1.1 基本要素
建议在 3.2.P.2.2.1 处方开发章节阐明制剂的目标产品质量概况 ( quality targetproduct profile,QTPP) 、关键质量属性( critical quali-ty attribute,CQA) 及其确定的依据。鼓励申请人参考 ICH Q9 的思路,在处方工艺开发以及生产实施的不同阶段合理运用质量风险管理工具[6] ,并在 3.2.P.2 的相关章节中提供具体的信息和数据。在此基础上,基于对产品、工艺的深入理解,制定合理的控制策略,以确保得到持续稳定的制剂产品质量。
3.1.2 控制策略
ICH Q8 建议可在 P.5.6 制剂质量标准制定依据章节中对制剂的总体控制策略进行概述,与此同时,除了制剂的质量标准控制,还需在其他相应章节[如原料药章节( S) 、生产工艺和过程控制( P.3.3) 、关键步骤和中间体的控制( P.3.4) 、辅料的控制( P.4) 、包装系统( P.7) ]中,提供关于物料控制和工艺控制的详细资料,对于控制策略的制定依据则可在 3.2.P.2 的相应章节中进行说明。应根据近年发布的 ICH M7( R1) 评估和控制药物中 DNA反应性( 致突变) 杂质以限制潜在致癌风险[7] 、ICHQ3D( R1) 元素杂质[8] 这 2 个指导原则的相关要求提供致突变杂质、元素杂质的控制策略。
3.1.3 常见问题
目前制剂申报资料中常见问题包括: 缺少 QTPP 和 CQA 的相关分析和说明; 仅基于 QTPP 简单分析 CQA,而未结合先验知识、处方工艺开发数据和风险评估等信息不断完善对 CQA 的评估和确定; 对于质量风险管理工具的理解不够深入,未选择适宜的风险分析和评估模型; 仅提供风险评估总结而未提供具体的评估方法和数据; 未对制剂总体的控制策略进行总结和归纳说明,未说明各个控制策略制定依据等。
建议申请人结合 ICH Q8 中的相关技术要求,采用适宜的方式,如文字或结合图形、表格等来进行申报资料的整理和撰写。例如在章节 P.2.1,P.2.2和 P.2.3 中可以阐明物料属性和工艺参数与 CQA之间的相互关系、关键工艺参数( critical processparameter,CPP) 和关键物料属性( critical materialattributes,CMA) 的确定,以及支持上述结论所开展的研究,包括风险评估过程和结果等; 对于关键工艺参数被证明的可接受范围( proven acceptable range,PAR) 可在 P.2.3 生产工艺的开发章节提供相关支持性研究和验证数据[5,9] 。
表 1 提供了某生物药剂学分类系统( biopharma-ceutics classification system,BCS) 2 类薄膜包衣片CQA 与关键控制策略关联性的分析示例[10] ,表中分别列举了制剂 QTPP 及与其相关的 CQA,并讨论了不同的工艺控制和物料属性( 包括原辅包) 与 CQA的相关性,最终依此确定终产品的控制策略。
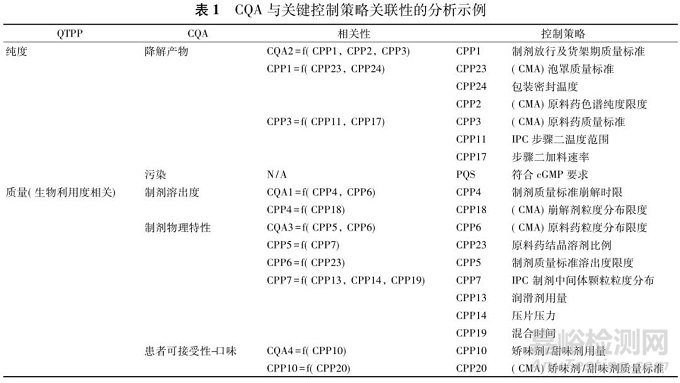

3.2 原料药的开发和生产
在 CTD 的 3.2.S.2 生产模块中仅指出了物料的质量控制可参考 ICH Q3A 和 Q6A 相关要求,对于原料药质量控制策略具有至关重要影响的工艺开发、工艺验证等章节则未指明可参考的相关指南,而且国内也尚没有可参考的相关指导原则,这些环节研究的不足也导致了在原料药后续生产中存在工艺不稳定、质量波动、工艺难以放大等问题。
在 2012 年发布的 ICH Q11 原料药的开发和生产[11] 以及 2017 年发布的 Q11 问答文件 [12] 中,结合Q8 药品研发、Q9 质量风险管理、Q10 药品质量体系的相关理念,阐述了采用增强型方法对原料药进行开发和生产的建议,因此在准备原料药申报资料时需重点关注。
3.2.1 基本要素
建议在 S.2.6 生产工艺的开发章节说明原料药 CQA,并提供确定这些性质或特性作为 CQA 的理由,同时在各个相应的章节提供支持性研究数 据 和 信 息 ( 如 S. 3. 1 结 构 和 理 化 特 性,3. 2. S. 7 稳定性) 。鼓励申请人在原料药工艺开发以及生产实施的不同阶段合理运用质量风险管理工具,并在 S.2.6 中说明用于指导和论证研发决策的相关风险评估信息。
3.2.2 控制策略
ICH Q11 建议可在 S.4.5 原料药质量标准制定依据章节总结原料药的全部控制策略,同时,对于物料控制、工艺控制及原料药质量标准的详细信息应该在 CTD 的相应章节提供[如S.2.2 生产工艺描述和过程控制、S.2.3 物料控制( 特别是关键起始物料) 、S.2.4 关键步骤和中间体的控制、S.4.1 原料药的质量标准]。关于生产工艺开发过程中控制策略的相关变更应在 S.2.6 中提供。Q11 及其问答文件中还重点强调了应如何论证起始物料指定的合理性,如何建立合理的起始物料质量标准。
3.2.3 常见问题
目前原料药申报资料中常见问题包括: 缺少 CQA 的相关分析和说明; 未对原料药总体控制策略进行总结和归纳说明; 未参照指导原则的要求论述起始物料选择的合理性,特别是未根据起始物料的制备工艺对其可能引入的杂质进行研究分析( 如仅提供少量批次杂质检测结果,未对主要检出的含量较高的杂质进行归属研究) ,未考察后续工艺步骤对相关杂质的转化/清除能力并确定哪些杂质对原料药杂质谱具有影响,从而导致起始物料、关键中间体的杂质控制策略存在缺陷等。表 2 提供了某化药原料药控制策略的总结概述示例。


3.3 生物制品需关注的问题 [2,13]
ICH M4 中对生物制品的要求主要针对基因工程重组产品,根据疫苗研究的特点,还需特别关注对生产用菌( 毒) 种、佐剂、病毒灭活、多联/多价疫苗等方面的考虑。佐剂是疫苗特有的组分,在制剂中的作用非常重要,一般应按照新辅料进行要求,除了提供生产工艺、特性鉴定、质量控制、稳定性等研究资料外,必要时还需提供非临床研究资料,因此需要在 3.2.P 制剂项下提交佐剂的概述信息,在 3.2.A.3辅料项下提交完整的药学研究信息。细菌及病毒疫苗有灭活步骤,而该步骤不同于外源因子清除灭活,因灭活后的细菌或病毒是需要的目标成分,因此这部分研究资料应放在 3.2.S.2 生产项下; 对于非目标成分的外源因子去除及安全性评价信息,应放在 3.2.A.2 外源因子的安全性评价项下。对于多价疫苗,根据各型组分生产工艺和质量控制的差异情况考虑申报资料的组织方式,如果较为相似,可在同一 3.2.S 原液章节中描述,如果差异较大,可分别提交单独的 3.2.S 原液章节。当产品含有多种组分时( 如联合疫苗或附带稀释剂) ,可每个组分分别提供一个完整的原液和/或制剂章节。
另外,随着近年新兴技术和生物制品的快速发展,生物制品的类型和组成也越来越多样和复杂,在实施 M4 指导原则时也需特别关注。对于细胞和基因治疗产品,可根据其特点,在原液和/或制剂相应部分提交药学研究资料,例如,关键原材料中的质粒和病毒载体的药学研究资料,可参照 CTD 格式和内容的要求在“3.2.S.2.3 物料控制”部分提交完整的药学研究资料。对于抗体药物偶联物或修饰类制品,小分子药物药学研究资料可按照 CTD 格式和内容的要求单独提交整套 3.2.S 研究资料,也可在“3.2.S.2.3 物料控制”中提交所有的药学研究资料。
3.4 区域性信息
CTD 中规定各个国家地区的监管机构可在3.2.R 区域性信息中明确原料药和/或制剂资料的其他申报资料要求,申请人应查阅相应的区域性指导原则和/或向各监管机构咨询是否有其他指南。如美国 FDA 要求在区域性信息中提供执行批记录、方法学验证包和可比性方案,欧洲 EMA 要求提供制剂工艺验证方案,日本则未提出具体要求。
对于化学药品来说,我国现行申报资料要求中未明确具体的区域性信息,建议申请人参考现行法律法规、相关技术指导原则进行申报资料的整理和提交,需重点关注的内容包括: ① 工艺验证报告,原80 号公告中仅要求提供无菌原料药和制剂无菌工艺步骤,以及采用特殊工艺制剂的工艺验证报告。新《药品注册管理办法》第三十四条规定申请人应完成商业规模生产工艺验证后提出药品上市许可申请,且按照申报资料要求提交相关研究资料。因此申请人应参照新法规的相关要求提供工艺验证报告。② 批记录,为便于开展生产工艺合理性的相关审评、提高生产工艺信息表的核定效率,建议提供执行的批记录,以及关键临床批次的批生产记录和检验报告( 如适用) 。③ 可比性方案,对于某些复杂产品如非生物复杂大分子药物( non-biological complexdrugs,NBCDs) ,适用时可在区域性信息中提交可比性方案[14] 。④ 为使申报资料正文部分重点突出,避免篇幅冗长,可在 S.4.3,P.5.3 分析方法验证章节、S.7,P.8 稳定性章节中提交精炼的总结信息和数据,在 3.2.R 部分提供详细的分析方法验证报告、典型图谱和稳定性研究的典型图谱。
对于生物制品,2020 年第 43 号公告[2] 中明确了区域性信息要求,主要包括: ① 工艺验证方案和报告,此处的工艺验证方案和报告与正文 3.2.S.2.5 和3.2.P.3.5 工艺验证和/或评价相比,应该提供更加详细完整的信息,体现验收标准、验证批次和规模、具体工艺参数、过程控制等内容。② 批记录,临床试验申请时,提供代表临床试验用样品工艺的批生产、检验记录,对具体批次数没有要求; 上市申请时,提供关键临床代表性批次和至少连续三批拟上市规模验证批的批生产、检验记录,并提供上述批次的检验报告。③ 分析方法验证报告,提供完整的分析方法验证报告,包含典型图谱。④ 稳定性图谱,提供稳定性研究典型原始图谱,尤其是关键质量属性或敏感指标,包括进样时间、分析时间、积分等信息,主要是为了更全面地进行评价。⑤ 可比性方案,主要考虑与后续 ICH Q12 全生命周期中的变更管理相衔接。⑥ 其他,可提供M4 正文及3.2.R 区域性信息未提出明确要求但有必要提交的其他申报资料内容,如生物类似药的质量相似性评价部分等。
四、结语
ICH M4Q 是经 ICH 协调统一的药学申报资料格式规范,该指南的实施强化了质量控制的理念,提高了药学申报资料的撰写水平和审评效率。然而随着制药行业和监管界的不断革新,新的技术指南的发布和实施,M4Q 现行 R1 版本也不可避免地暴露出了一定的局限性。如近年来美国的行业协会一直在推动进行 2.3.S 和 2.3.P 质量综述的格式修订,拟增加章节用于提供原料药和制剂整体的、系统的控制策略,以改良现行版本中控制策略分散在各个不同章节的缺陷; EMA 则一直在推动针对特殊人群用药( 如老年人群、儿童人群等) 进行申报资料格式的进一步细化,以便于申请人和审评员均能更加明确、直观地围绕特殊人群的特定需求开展研究和相应的审评。另外现阶段随着 ICH Q12 的全面实施,针对新提出的既定条件( ECs) 、批准后变更管理方案( PACMP) 等要求,如何科学、合理地进行整理和撰写,也对 M4Q 提出了一步的挑战。未来将需要工业界与监管机构一并积累经验,探讨适宜的改革方案。

来源:中国药房


