您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-09-12 22:56
摘 要·Abstract
美国FDA 针对所有治疗严重疾病的化学药品和生物制品制定了4 种加快注册政策:快速通道资格、突破性疗法资格、优先审评资格、加速批准。除了适用于以上加速政策外,为促进再生医学疗法的研发和加快审评,以解决严重疾病患者未满足的医疗需求,FDA 专门为治疗严重疾病的再生医学疗法制定了一种加快政策再生医学先进疗法认定。本文将主要介绍美国针对再生医学疗法的5 种加快注册的激励政策,尤其是再生医学先进疗法认定。并且对我国新修订《药品注册管理办法》修订前后的加快药品注册程序进行比较。
The US FDA has launched four expedited regulatory programs for serious conditions for chemical drugs and biologics, including fast track designation, breakthrough therapy designation, priority review designation, and accelerated approval. In addition to these expedited programs, to facilitate development and regulatory review of regenerative medicine therapies intended to address unmet medical needs in patients with serious conditions, FDA introduced “regenerative medicine advanced therapy” (RMAT) designation for regenerative medicine therapies. This article mainly introduces five expedited programs for regenerative medicine therapies, particularly the RMAT designation, and compares these programs with those in China in place before and after issuance of the newly-revised Provisions for Drug Registration.
关键词 · Key words
药品;再生医学疗法;严重疾病;加快注册政策
medical products; regenerative medicine therapy; serious conditions; expedited programs for drug review
再生医学领域发展迅速,在治疗严重疾病方面特别是对于未满足医疗需求的患者具有巨大的应用潜力。2020 年, 美国FDA 定稿了《用于严重疾病的再生医学疗法的加速计划行业指南》(Expedited Programs for Regenerative Medicine Therapies for Serious Conditions Guidance for Industry)[1]。该行业指南由生物制品审评与研究中心(Centerfor Biologics Evaluation and Research,CBER) 起草, 旨在促进再生医学疗法的研发和加快审评,以解决严重疾病患者未满足的医疗需求。该行业指南是在2014 年美国FDA 的药品审评与研究中心(Center for Drug Evaluation and Research,CDER) 和CBER 联合发布的针对所有严重疾病的化学药品和生物制品加速审评政策的基础上进一步制定的。除了适用于所有治疗严重疾病的药品的快速通道资格、突破性疗法资格、优先审评资格、加速批准4 种途径外, 新增了一种专门用于再生医学疗法的再生医学先进疗法认定(regenerative medicine advanced therapy,RMAT)。根据2015~2020 年美国CDER的年度审评报告显示,当年批准的新药有60%~73% 在研发和审批过程中至少使用了一项加快研发和审评的政策。其中2020 年度审评报告显示[2],68%(36/53)批准的新药在研发和审批过程中至少使用了一项加快研发和审评的政策。32%(17/53) 获得快速通道资格,42%(22/53) 获得突破性疗法资格,57%(30/53)获得优先审评资格,23%(12/53)获得加速批准。相比之下,再生医学先进疗法认定和加速政策的应用经验比较有限。本文主要介绍美国针对再生医学疗法的5 种加快注册的激励政策,尤其是再生医学先进疗法认定。并且对我国新修订《药品注册管理办法》修订前后的加快药品注册程序进行比较。
1 再生医学疗法的定义
美国《联邦食品药品和化妆品法案》506(g)(8)中规定,再生医学疗法包括细胞疗法、基因疗法、治疗性组织工程产品、人体细胞和组织产品,以及上述类型的组合产品。该法案对再生医学疗法的概念范围进行了限定,不包括《公共卫生服务法案》第361 节和《联邦法规汇编》第21编第1271 部分所规定的产品。《用于严重疾病的再生医学疗法的加速计划行业指南》将对细胞和组织产生持续影响的基因疗法,包括基因修饰的细胞疗法包含在再生医学疗法的范围之内[1]。以上产品由FDA 的组织和先进疗法办公室(Office of Tissues andAdvanced Therapies,OTAT)进行审评,截至2021 年2 月5 日,OTAT 共批准了19 个产品上市。主要包括用于造血前体细胞移植的异体骨髓血细胞、用于修复软骨的自体软骨细胞、用于改善法令纹的自体成纤维细胞、用于治疗黏膜牙龈症状的异体角质细胞、用于治疗黑色素瘤的溶瘤病毒、用于治疗转移性前列腺癌的细胞疗法、用于治疗白血病和(或)淋巴瘤的嵌合抗原受体T 细胞、用于治疗视网膜色素变性的腺相关病毒载体基因疗法、用于治疗运动神经元存活基因1(SMN1)基因突变的脊髓性肌萎缩症的基因疗法等[3]。除用于造血前体细胞移植的异体骨髓血细胞外,其他11 个产品详见表1。
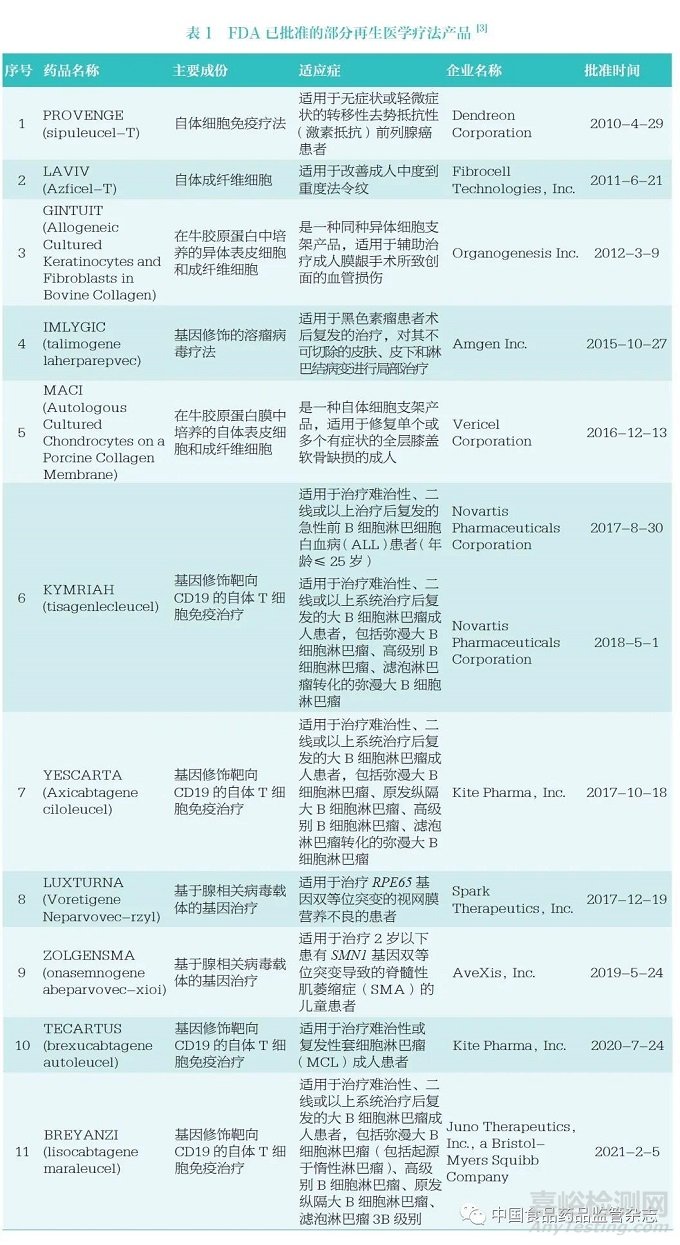
2 加快政策
近年来,细胞疗法和基因疗法发展较快,批准上市的产品数量却非常少。为加速再生医学产品的研发和上市,FDA 专门为再生医学疗法制定了政策,以再生医学先进疗法认定来加强对企业的指导。同时,再生医学疗法还适用于2014 年发布的针对药品和生物制品的所有加速政策,如快速通道、突破性疗法、加速批准、优先审评[4]。快速通道、突破性疗法、加速批准、优先审评与再生医学先进疗法认定互相并不冲突,临床试验期间,研发单位可同时、单独申请一到多个认定。快速通道资格认定和突破性疗法资格认定主要用于临床试验过程中,在临床试验早期可获得监管机构的研发指导,以及提交部分申报资料用于审评。
2.1 快速通道资格认定
治疗严重疾病且临床或非临床数据显示有解决此类疾病患者未满足的临床需求潜力的新药,可以获得快速通道资格认定。例如,在研发早期,体外试验或者动物模型中得到的药效学数据,足以支持其具有解决未满足临床需求的潜力。如果某个再生医学疗法的临床或非临床数据证实其具有这种潜力,且具体临床研发项目设计为了解决严重疾病未满足的临床需求,那么FDA 会考虑授予其快速通道资格。获得快速通道资格认定的新药可以获得促进研发和加快审评的政策支持。例如,在企业提交了临床数据显示该药可能有效的情况下,FDA可能允许滚动提交申报资料。另外,获得快速通道资格认定的药品如果其临床试验数据符合相关要求,可在上市许可申请提交时获得优先审评的资格[1,4]。
2.2 突破性疗法资格认定
突破性疗法资格认定用于治疗严重疾病且初步临床试验数据显示对现有疗法在一个到多个重要临床终点上具有明显改善作用的新药,可能获得突破性疗法资格认定。获得突破性疗法资格认定的新药,能够享受所有快速通道认定的政策支持,如加强研发指导、滚动审评等。另外,FDA还承诺高层管理人员参与与企业的沟通来促进药品的研发[1,4]。
突破性疗法资格认定所需的证据级别高于快速通道资格认定,其与现有疗法相比,明显改善重要临床终点的初步临床试验数据一般来自Ⅰ期或Ⅱ期临床试验。例如,在一项开放标签的首次人体试验中,针对现有疗法难以治疗的转移性乳腺癌,注射表达肿瘤特异性抗原的异体肿瘤细胞系进行免疫治疗,相当比例的受试者获得了完全缓解。针对年龄相关性黄斑变性晚期患者,通过视网膜下注射视网膜色素上皮细胞进行治疗,在治疗1 年后,视敏度或视野显著改善,或者地图样萎缩面积显著缩小。又如,针对行动能力受限的严重骨关节炎患者,在关节内注射含有造血干细胞生成的细胞的平衡缓冲溶液与仅注射平衡缓冲溶液相比,可显著缓解疼痛和改善功能[1]。
2.3 优先审评资格认定
用于治疗严重疾病且对现有疗法的安全性或有效性具有显著改善的新药,可以在上市前沟通会上与FDA 讨论优先审评的可能性,并在提交上市许可申请时进行申请。再生医学疗法如符合上述条件也可申请优先审评资格。FDA 会在6 个月内完成对获得优先审评资格认定的药品的审批[1,4]。
2.4 加速批准
加速批准程序主要用于病程较长、需要一个扩展的时间段来评估药品的预期临床获益状况的情况。治疗严重或危及生命的疾病,与现有疗法相比具有优势,且显示出具有改善可能预测临床终点的替代终点或者比临床终点更早测量到的中间临床终点表现的新药,包括再生医学疗法。FDA 考虑疾病严重程度、是否罕见病、发病率以及该疾病是否有可用药物等因素,可基于替代终点或中间临床终点做出审批决定。获得再生医学先进疗法认定的药品,如果事先与FDA 就能预测长期临床获益的替代终点或中间临床终点达成一致,或者具有从一定数量的临床研究中心获得的数据,那么可能会获得FDA 的加速批准。FDA 看重不同研究中心数据的一致性,如多个研究中心的主要终点指标均显示出疗效,这决定了该药有效性数据是否可以可靠地外推到其他研究中心。基于此获得加速批准的再生医学疗法,FDA 可能会要求其提供上市后外推到其他研究中心的临床试验数据。
通过加速批准的药品,上市后仍需进行确证性试验以证实预期的临床获益。如果确证性临床试验表明该药确实具有临床获益,FDA 将对该药再进行常规程序的批准。对于再生医学疗法来说,加速批准后的上市后要求通常包括提交临床研究或者真实世界证据、收集更多的确证性试验数据、上市后监测所有使用该疗法的患者直至获得常规批准[1,4]。
2.5 再生医学先进疗法认定
治疗严重疾病且初步临床证据显示再生医学疗法有解决此类疾病患者未满足的临床需求潜力的,可以授予再生医学先进疗法认定。由再生医学产品与医疗器械或化学药品组成的组合产品,当再生医学产品是起主要治疗作用的成份时,也可以申请再生医学先进疗法认定。再生医学先进疗法认定不需要提供与现有治疗相比疗效更加显著的证据。初步临床证据一般来自评估其对严重疾病的治疗效应的临床研究,并不一定是平行对照的前瞻性临床试验,有可能是历史对照的临床研究、设计良好的回顾性研究、病例集,前提是该临床证据中所使用的产品与进行临床试验的是同一个产品。在评价初步临床证据时,FDA 会考虑以下因素:数据收集的质量、结果的一致性和说服力、受试者的数量、研究中心的数量、该疾病的严重程度、是否罕见以及发病率等。例如,在剂量探索的Ⅱ期临床试验中,向现有疗法难以治疗的晚期心力衰竭患者心肌内注射异体的角质细胞和间充质前体细胞产品,在多个左心室生理功能上有剂量依赖的改善。获得该认定可以享受快速通道资格和突破性疗法资格的所有政策,并在早期与FDA 互动可以讨论加速批准中替代终点或中间临床终点的可能性以及上市后要求等[1]。
2.5.1 申请程序
企业可以基于已有的新药临床试验申请(investigational new drug,IND) 的再生医学疗法申请再生医学先进疗法认定,也可以在申请新的IND 同时申请再生医学先进疗法认定。申请包括以下内容:①描述产品特征,如何符合再生医学疗法的定义。②对要治疗的适应症是严重疾病的讨论。③获益- 风险评估。④描述该产品有潜力解决未满足的临床需求。⑤证明该产品有潜力解决严重疾病未满足临床需求的初步临床证据,包括疾病、结果评估、患者监测、患者特征以及研究的设计、实施和数据分析。FDA 会在60 个日历日内告知企业是否授予再生医学先进疗法认定。如果在研发后期发现,该产品不再符合再生医学先进疗法认定,FDA 会取消该认定[1]。
2.5.2 申请认定情况
再生医学先进疗法认定于2016 年12 月13 日开始实施,在2017~2020 年期间, 共有149 个再生医学先进疗法认定的申请,2017~2020 年的申请数分别为31、47、37、34 个,共有58 个获得授予认定,平均授予率为39%。每年的授予认定、拒绝认定、撤回认定的数量详见图1[5]。尚未有认定被FDA 撤销的情况。
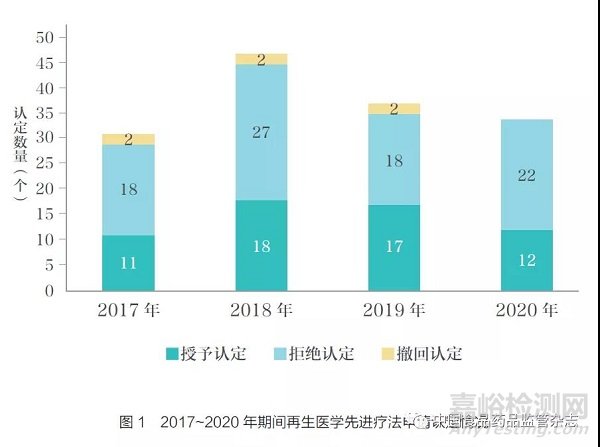
截至2018 年4 月, 获得再生医学先进疗法认定的产品也基本上获得了其他至少一种加快政策的支持。另外,支持该认定的临床证据包含从Ⅰ / Ⅱ期临床试验的中期分析数据、已完成的Ⅱ期临床试验、正在进行的Ⅱ / Ⅲ期临床试验、已完成的Ⅲ期临床试验等获得的多种情况[6]。
3 我国加快药品注册的政策
3.1 原有的加快政策
我国曾发布多个加快药品注册特别是新药注册的政策,以加强研制指导和缩短药品注册时限。
2005 年,《国家食品药品监督管理局药品特别审批程序》发布,并指出存在发生突发公共卫生事件的威胁时以及突发公共卫生事件发生后,为使突发公共卫生事件应急所需防治药品尽快获得批准,对以下突发公共卫生事件应急所需防治药品实行特别审批:中华人民共和国主席宣布进入紧急状态或者国务院决定省、自治区、直辖市的范围内部分地区进入紧急状态时;突发公共卫生事件应急处理程序依法启动时;国务院药品储备部门和卫生行政主管部门提出对已有国家标准药品实行特别审批的建议时;其他需要实行特别审批的情形[7]。在药品注册申请受理、现场核查、注册检验、技术审评、临床试验、行政审批等各个环节积极指导,尽力缩短时限。
2009 年,为了鼓励研究创制新药和加强风险控制管理,原国家食品药品监督管理局制定了《新药注册特殊审批管理规定》,对符合下列情形的新药注册申请实行特殊审批:未在国内上市销售的从植物、动物、矿物等物质中提取的有效成份及其制剂,新发现的药材及其制剂;未在国内外获准上市的化学原料药及其制剂、生物制品;治疗艾滋病、恶性肿瘤、罕见病等疾病且具有明显临床治疗优势的新药;治疗尚无有效治疗手段的疾病的新药[8]。特殊审批政策增加了药品补充资料的渠道,除常规的补充资料外,还可以对新发现的重大安全性信息、根据审评会议要求准备的资料、沟通交流所需的资料等补充新的技术资料;补充资料的时长由常规的4 个月延长至8 个月;增加了沟通交流的机会:申请人在完成某一阶段临床试验及总结评估后,可就重大安全性问题、临床试验方案、阶段性临床试验结果的总结与评价等问题向药品审评中心提出沟通交流申请。
2015 年发布的《国务院关于改革药品医疗器械审评审批制度的意见》中,提出了对创新药实行特殊审评审批制度。加快审评审批防治艾滋病、恶性肿瘤、重大传染病、罕见病等疾病的创新药,列入国家科技重大专项和国家重点研发计划的药品,转移到境内生产的创新药和儿童用药,以及使用先进制剂技术、创新治疗手段、具有明显治疗优势的创新药。加快临床急需新药的审评审批等[9]。
2016 年和2017 年,原国家食品药品监督管理总局分别发布了《总局关于解决药品注册申请积压实行优先审评审批的意见》[10]和《总局关于鼓励药品创新实行优先审评审批的意见》[11],对具有明显临床价值且符合以下情形的可以实行优先审评审批:未在中国境内外上市销售的创新药注册申请;转移到中国境内生产的创新药注册申请;使用先进制剂技术、创新治疗手段、具有明显治疗优势的药品注册申请;专利到期前3 年的药品临床试验申请和专利到期前1 年的药品生产申请;申请人在美国、欧盟同步申请并获准开展药物临床试验的新药临床试验申请;在中国境内用同一生产线生产并在美国、欧盟药品审批机构同步申请上市且通过了其现场检查的药品注册申请;在重大疾病防治中具有清晰的临床定位的中药(含民族药)注册申请;列入国家科技重大专项或国家重点研发计划的新药注册申请;以及防治艾滋病、肺结核、病毒性肝炎、罕见病、恶性肿瘤、儿童用药品、老年人特有和多发的疾病且具有明显临床优势的药品注册申请;临床急需、市场短缺的药品注册申请等。对列入优先审评审批的药品注册申请,优先配置资源进行技术审评、沟通交流、现场核查、药品检验。同时,还提到了对于罕见病或其他特殊病种,可以在申报临床试验时提出减少临床试验病例数或者免做临床试验的申请;对于治疗严重危及生命的疾病且尚无有效治疗手段、对解决临床需求具有重大意义的新药,若根据早期临床试验数据,可合理预测或判断其临床获益且较现有治疗手段具有明显优势,允许在完成Ⅲ期确证性临床试验前有条件批准上市。内容与前文基本相同。
随着药品审评审批制度改革的推进,加快药品注册的制度不断发布和完善,先后单独发布的政策针对多种情形设置了不同的加快政策,鼓励了药品研发和创新,但多项政策涉及的范围存在互相重叠现象[10-11]。
3.2 新的法律法规框架下的加快政策
2019 年12 月1 日实施的新修订《药品管理法》中规定,国家采取有效措施,鼓励儿童用药品的研制和创新,支持开发符合儿童生理特征的儿童用药品新品种、剂型和规格,对儿童用药品予以优先审评审批;国家鼓励短缺药品的研制和生产,对临床急需的短缺药品、防治重大传染病和罕见病等疾病的新药予以优先审评审批[12]。将对儿童用药、临床急需用药、防治重大传染病和罕见病用药等的鼓励政策写入法律。
2020 年7 月1 日实施的《药品注册管理办法》总结了既往加快药品注册政策的实施经验,重新设置了加快药品注册的政策,系统且全面地覆盖了药品注册的多种情形。明确了为支持以临床价值为导向的药物创新,申请人可以申请适用突破性治疗药物、附条件批准、优先审评审批及特别审批程序。在药品研制和注册过程中,药品监管部门及其专业技术机构给予必要的技术指导、沟通交流、优先配置资源、缩短审评时限等政策和技术支持。
药物临床试验期间,用于防治严重危及生命或者严重影响生存质量的疾病,且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等,申请人可以申请适用突破性治疗药物程序。对纳入突破性治疗药物程序的药物临床试验,可以获得更多的沟通交流和基于已有阶段性研究资料的研究指导。
治疗严重危及生命且尚无有效治疗手段的疾病的药品、公共卫生方面急需的药品、应对重大突发公共卫生事件急需的疫苗或者国家卫生健康委员会认定急需的其他疫苗,在符合相应要求的情况下,可以做好风险管理措施,附条件批准上市,完成相应条件要求的研究后,再申请常规上市。
具有明显临床价值的符合以下条件的药品,可以申请适用优先审评审批程序:临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药;符合儿童生理特征的儿童用药品新品种、剂型和规格;疾病预防、控制急需的疫苗和创新疫苗;纳入突破性治疗药物程序的药品;符合附条件批准的药品;国家药品监督管理局规定其他优先审评审批的情形。对列入优先审评审批程序的药品,尤其是治疗罕见病的药品缩短了技术审评时限,且优先安排核查、检验和核准药品通用名称,经沟通交流确认后,可以补充提交技术资料。
在发生突发公共卫生事件的威胁时以及突发公共卫生事件发生后,对突发公共卫生事件应急所需防治药品实行特别审批。加快并同步开展药品注册受理、审评、核查、检验工作[13]。
4 结语
近年来,随着科学技术的进步和我国科研投入的增加,细胞和基因治疗产品等创新性生物疗法基础研究和临床应用不断进展。我国药品监管部门通过“中国药品监管科学行动计划”等多种方式,加强与高校、科研院所和相关企业等的合作和互动,组织制定了《细胞治疗产品研究与评价技术指导原则(试行)》[14]、《免疫细胞治疗产品临床试验技术指导原则(征求意见稿)》[15]、《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(征求意见稿)》[16]、《溶瘤病毒类药物临床试验设计指导原则(征求意见稿)》[17]、《免疫细胞治疗产品药学研究与评价技术指导原则(征求意见稿)》[18]、《基因转导与修饰系统药学研究与评价技术指导原则(征求意见稿)》[19]等一系列相关指导文件。
产品研发的进展、国外细胞和基因治疗产品的相继批准上市以及指导文件的出台,助推了企业按照药品注册申报细胞和基因治疗产品。2017~2020 年共批准了58 个细胞和基因治疗产品开展临床试验,数量逐年增加。其中,免疫细胞治疗产品36 个,主要是嵌合抗原受体T 细胞,此外还有双阴性T 细胞、抗原致敏的免疫细胞等;干细胞产品15 个,主要是脐带、脂肪、骨髓、牙髓来源的间充质干细胞等;基因治疗产品包括溶瘤病毒产品共7 个,涉及的载体主要有疱疹病毒、痘苗病毒、腺相关病毒、质粒等。
我国细胞和基因治疗产品与其他药品一样适用新修订《药品注册管理办法》中的4 种加快注册程序,没有专门针对该类产品的相关政策。截至2021 年2 月26 日,共有5 个产品纳入突破性治疗药物[20],共有2 个产品纳入优先审评审批[21]。该类产品从基础研发到临床应用历时较短,且科技进展日新月异。因此,在注册申报前和开展临床试验期间,监管机构与企业需要进行大量的沟通交流。通过构建多渠道、多层次的沟通交流机制,鼓励创新药的研发和申报,加快药品上市步伐。新修订《药物研发与技术审评沟通交流管理办法》[22] 中已增加了针对突破性治疗药物、附条件批准和优先审评审批等的沟通交流类型,通过具体产品和具体问题具体分析,共同推动临床急需的、有突出临床价值的细胞和基因治疗产品进入临床试验和尽早上市,早日惠及我国患者。
第一作者简介
赵晨阳,博士,国家药品监督管理局药品审评中心,助理研究员。专业方向:细胞和基因治疗产品临床审评研究
共同第一作者简介
黄云虹,博士,国家药品监督管理局药品审评中心,助理研究员。专业方向:细胞和基因治疗产品临床审评研究
通讯作者简介
高晨燕,国家药品监督管理局药品审评中心,主任药师。专业方向:新药临床审评研究

来源:未知


