您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-06-28 20:43
2018年8月31日,国家药品监督管理局官网发布的《医疗器械不良事件监测和再评价管理办法》(国家市场监督管理总局令第1号)(下文简称《办法》)给医疗器械注册人提出了一系列新的工作要求,其中就包括对上市后的医疗器械撰写定期风险评价报告。根据《办法》第二章第十四条"持有人的主要义务"的内容,持有人应做到建立体系、配备人员和机构、报告不良事件、控制风险、发布信息、撰写定期风险评价报告、再评价、配合调查。本文就对在撰写该报告过程中的要点进行了整理,供大家参考。
主要要求
1. 定期风险评价报告的撰写周期
(1)首次注册或备案后,每年撰写1次;
(2)延续注册后,约5年1次。
2. 报告期内的安全性信息要求:连续、无遗漏、不重复。
3. 对评价内容的要求:
(1)对风险信息的汇总;
(2)对不良事件监测信息进行的分析;
(3)对其他风险信息的综合;
(4)对上市后风险的评价:风险是否有变化、是否可接受。
4. 对报告的总体要求:
(1)完整、规范化;
(2)有逻辑结构(介绍、数据、分析、结论);
(3)可识别(日期、版本、注册人与联系人等)。
撰写要点
1. 总览的撰写要点
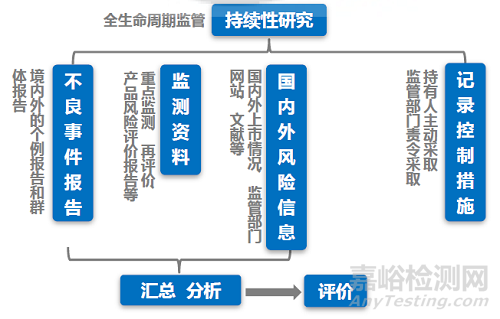
注意:(1)即使没有发生不良事件,仍需要定期按时提交定期风险评价报告;(2)不良事件报告是定期风险评价报告中的一部分,但不是全部内容;(3)监测资料是国内外风险信息的汇总和分析。
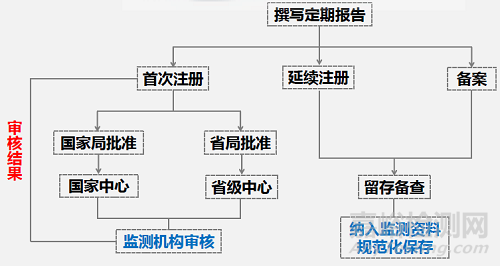
注意:(1)对于首次注册的第二、三类产品,网上提交资料后,依据审批机构的不同,会由国家药监局或省级药监局进行审核,审核结果可在网上查询;(2)对于延续注册和备案产品,不要求在线提交定期风险评价报告,撰写完成后留存备查即可,但同时需把其纳入监测资料规范化进行保存。
2. 正文内容的撰写要点
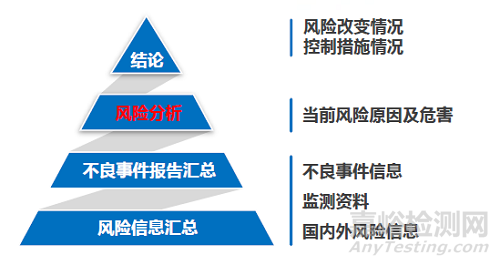
通过对医疗器械产品的不良事件进行监测,定期分析产品的风险是保障产品安全的重要途径之一。因此,在撰写定期风险评价报告时,注册人应从识别风险和原因分析两方面撰写风险分析,评估其对安全性的影响。识别风险包括以下内容。
(1)对不良事件的特点、频率、伤害严重程度等的分析;
(2)原因分析应从:设计、生产管理、流通与储存、使用因素等方面考虑。
在正文的结论部分,注册人应指出:
(1)指出本期报告与既往报告的风险分析结果差异;
(2)指出以上风险差异的可接受程度;
(3)总结采取的风险控制措施。

来源:Internet