您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-09-15 17:08
各种因疾病、创伤导致的骨缺损是现阶段临床中常见的骨科疾病。受限于损伤及患者状况的复杂性,许多过大或合并其他异常的骨缺损无法完全依靠人体自身的修复能力,而需要利用修复植入体来实现形态与功能的恢复。目前,国内外骨缺损修复中的植入材料主要包括异体骨、组织工程骨和人工骨,其中,人工骨因效果确切、质量可控且成本适宜,已具有不可取代的重要地位,并被广泛应用于临床治疗中。人工骨修复材料的种类多样,包括羟基磷灰石、生物活性玻璃、磷酸钙骨水泥等[1-3]。不同的材料在生物相容性和成骨性能等方面存在差异,并因此导致其应用范围存在差别。动态评价修复材料植入后的局部反应、成骨性能及与机体自身骨修复的适应能力,是决定其临床适应证及应用安全性与有效性的关键[4-5]。因此,寻找有效的评价方法,并将其应用于动物实验中来评价人工骨的安全性和有效性,为后续研究提供有效的数据支撑具有重要的意义[6-7]。基于此,本研究拟在GB/T 16886.6-2015《医疗器械生物学评价 第6部分:植入后局部反应试验》及YY/T 1575-2017《组织工程医疗器械产品修复和替代骨组织植入物骨形成活性的体内评价指南》等标准[8-9]的基础上,分析典型钙磷陶瓷人工骨动物实验中影像学及组织病理研究等各种方法在评估动态骨修复过程中给出的数据,考察各方法的优势,并给出综合评价方案的实例。
羟基磷灰石作为人工骨材料,已被广泛应用于临床中[10-11]。早在20世纪80年代,羟基磷灰石的骨诱导性即已被发现[12-13]。本研究所使用的实验样品及对照样品均为羟基磷灰石人工骨,其与人体骨无机成分相似,具有良好的生物相容性、骨传导性及骨诱导性,临床应用效果较好[14-15]。新型羟基磷灰石人工骨的研发方向之一即是以其为基质材料,引入各种无机物、有机物、金属等进行复合,以解决单纯的羟基磷灰石力学强度低、韧性差、无法应用在承力 骨中等局限性问题[16-18]。这些新技术可能带来新的与安全性、有效性相关的风险,因此,可能需要重新进行相应的评价。在当前的评价实践中,除了按照GB/T 16886.1标准进行的生物学评价外,针对其有效性及与成骨相关性质的 研究往往仍需要通过临床前动物实验来完成[19-20]。
1材料与方法
1.1 材料
1.1.1 实验动物
新西兰白兔30只[由邳州市东方养殖有限公司提供;生产许可证号:SCXK(苏)2017-0002 ;使用许可证编号:SCXK(川)-2013-14],体重2.0~3.0 kg,雌雄不限(雌兔未产无孕),均在普通环境下饲养,室温控制在 20~23 ℃,相对湿度控制在44%~52%,采用人工控制12 h光照、12 h黑暗。
1.1.2 实验样品
实验样品为羟基磷灰石人工骨,规格Φ5 mm×8 mm,白色圆柱体多孔材料;对照样品为已上市的羟基磷灰石人工骨,规格Φ5 mm×8 mm,白色圆柱体多孔材料。
1.1.3 主要仪器及软件
BX60奥林巴斯显微镜、DP22显微镜成像系统(Olympus Corporation公司,日本),小动物X线成像系统(kubtec,美国),viva CT 80(SCANCO MEDICAL,瑞士),EXAKT 300 CP/400 CS硬组织切磨系统(EXKT Apparatebau GmbH & Co.KG,德国),石蜡切片机及自动脱水系统(LEICARM2135 TP1020,德国),全自动染色机(Thermo Scientific Gemini AS,美国),包埋机(Thermo Fisher Histo Star,美国),Image-Pro Plus 6.0,Materialise Mimics Innovation Suite 19.0。
1.1.4 主要试剂
(1)HE染色:二甲苯(成都市科隆化学品有限公司),苏木素、伊红染液(Thermo)。(2)甲苯胺蓝染色:二甲苯(成都市科隆化学品有限公司),甲苯胺蓝染色液(索莱宝),丙酮(成都市科隆化学品有限公司)。(3)免疫组化:α-SMA一抗抗体(abcam),二抗试剂盒(中杉金桥),DAB 显色液(中杉金桥),抗原修复液(博士德)。
1.2 方法
1.2.1 动物分组
于各时间点随机分配,每个时间点10只。
1.2.2 手术方法
动物侧卧,用取骨环钻在其左右侧大腿股骨髁处各造 一个直径5 mm、深8 mm的圆柱形缺损,分别植入实验样品 及对照样品;于植入术后4、13、26周,分别处死动物,取出植入材料及其周围组织。
1.2.3 染色方法
(1)HE染色:切片脱蜡至水;苏木素染色5 min;流水冲洗;1% 盐酸分化数秒;自来水蓝化;伊红染色30 s ;脱水、透明、中性树胶封片。(2)甲苯胺蓝染色:切片脱 蜡至水;甲苯胺蓝染色液染色10 min;水洗;入丙酮分化至骨和软骨细胞清楚;脱水、透明;中性树胶封片。(3)免疫组化:切片脱蜡至水;高温抗原修复,切片入抗原修复液内微波20 min ;过氧化氢封闭10 min ;血清封闭10 min ;一抗4 ℃过夜孵育后,PBS冲洗;二抗孵育30 min 后,PBS冲洗;三抗孵育30 min后,PBS冲洗;DAB显色,适时自来水冲洗终止;苏木素淡染、蓝化、脱水、透明;中性树胶封片。
1.2.4 数据获取及评价方法
通过X线摄片观察结合Micro-CT 分析,评价骨缺损区域的骨形成、骨连接和骨塑形情况;通过组织病理学观察,评价骨缺损区域的组织性质、组织反应、骨形成、髓腔再通及成骨细胞数量。
本研究关注影像学及组织病理研究相结合对骨形成的评价,因此,研究中的组织病理切片位置的选取,将以影像学结果为基础。其原则为切片切面须包含植入样品与周边新生骨组织的交界处,并尽量沿骨形成与重塑的界面区域随机选择。
1.3 统计学处理
本研究中的定量数据,如切片上特定细胞的比较等,采用SPSS 2.3统计软件进行处理,各组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2结果
2.1 X线影像学检查及 Micro-CT分析
X线影像学检查结果见图1。植入术后即刻,样品组与对照组缺损模型位置准确,植入材料与自体骨贴合紧密,密度接近,但可见明显的界限,双侧股骨髁均未出现骨折及其他缺损;术后4周,样品组与对照组区域轮廓不清晰, 部分区域与自体骨界限模糊,可见骨连接,缺损区域密度增高,可见新骨形成;术后13周,样品组与对照组区域轮廓不清晰,与周边自体骨开始融合,与自体骨界限模糊,可见骨连接,缺损区域密度增高,可见新骨形成,双侧股 骨髁均未出现骨折及其他新的缺损;术后26周,样品组与对照组缺损区域消失,与自体骨无明显的界限。由此可见,本研究通过对骨缺损区域的X线摄片检查,可以较好地判断骨连接情况,但无法计算骨形成的准确面积,无法判断 皮质骨塑形及骨髓腔形成。
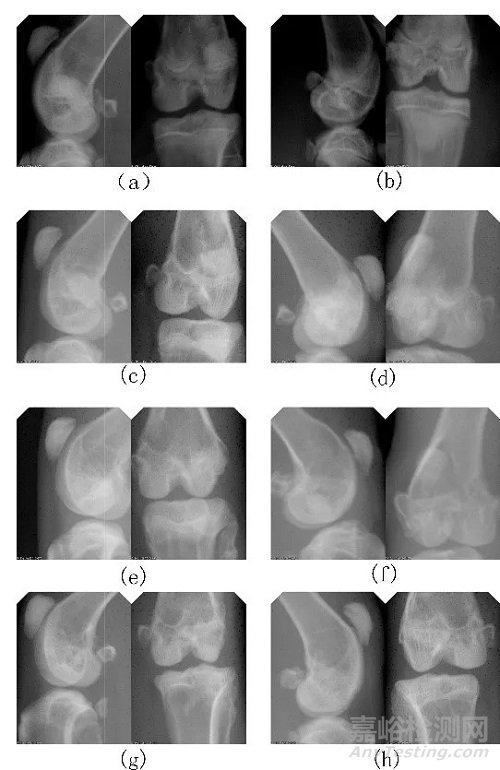
注:a为术后即刻样品组股骨髁X线片;b为术后即刻对照组股骨髁X线片;c为术后4周样品组股骨髁X线片;d为术后4周对照组股骨髁X线片;e为术后13周样品组股骨髁X线片;f为术后13周对照组股骨髁X线片;g为术后26周样品组股骨髁X线片;h为术后26周对照组股骨髁 X 线片
图1 X线影像学检查结果
Micro-CT结果见图2。植入术后4、13周,对照组降解程度大于样品组,至术后26周,对照组与样品组降解程度接近,但在现有分辨力的条件下无法定量计算各自的体积分数;通过对股骨髁三维重建情况进行分析发现,术后 4周,样品组与对照组骨缺损区域明显,未见明显骨塑形,而术后13、26周,样品组与对照组骨缺损区域皮质骨可见明显骨塑形,股骨髁外形基本恢复。
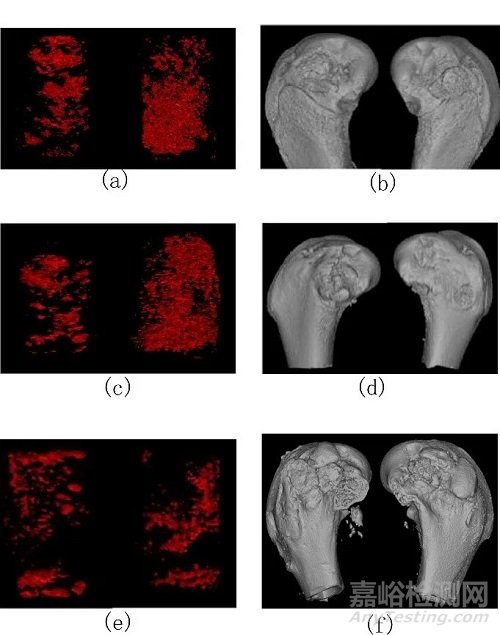
注:a为术后4周,对照组(左)样品组(右);b为术后4周股骨髁三维重建,对照组(左)样品组(右);c为术后13周,对照组(左)样品组(右);d为术后13周股骨髁三维重建,对照组(左)样品组(右);e为术后26周,对照组(左)样品组(右);f为术后26周股骨髁三维重建,对照组(左)样品组(右)
图2 Micro-CT 结果
2.2 组织病理学观察
2.2.1 组织性质、炎症反应、髓腔重塑(软组织HE染色)
植入术后26周实验样品和对照样品的组织学观察结果见图3。在植入术后26周,实验样品和对照样品的骨缺损区域见植入材料,材料周围见纤维组织、新骨形成及骨髓组织,纤维组织中可观察到极少量的炎症细胞,主要为多 形核白细胞、淋巴细胞、巨细胞。观察其他时间点HE染色 切片可见,样品组,术后4周,骨缺损区域未见明显骨髓腔的重塑,术后13周,在骨缺损区域外围的材料周围观察到少量的骨髓样组织,至术后26周,骨缺损区域可见广泛分布的骨髓组织;对照组,术后4周,在骨缺损区域外围的材料周围观察到少量的骨髓组织,术后13周,骨缺损区域内开始出现骨髓样组织,至术后26周,骨缺损区域骨髓组织广泛分布。由此可见,样品组及对照组骨缺损区域未见异常 组织及明显的炎症反应;术后26周,骨髓组织在缺损区域广泛分布,髓腔再通,骨缺损区域的髓腔逐渐形成。
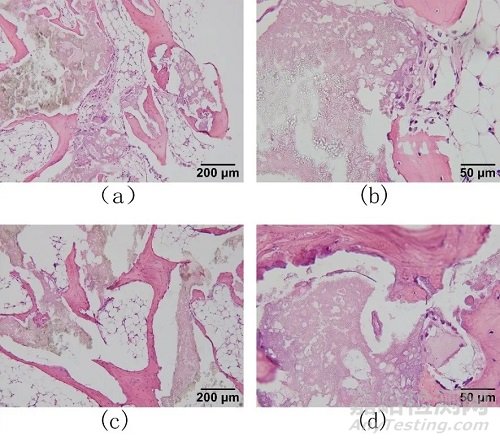
注:a为实验样品100×;b为实验样品400×;c为对照样品100×;d为对照样品400×
图3 植入术后26周实验样品和对照样品的组织学观察结果(HE染色)
2.2.2 纤维化(α-SMA染色)
实验样品和对照样品的α-SMA染色结果见图4。植入术后4周,实验样品和对照样品的骨缺损区域纤维组织广泛分布,且包裹区较厚;术后13周,虽然实验样品和对照样品的骨缺损区域纤维组织分布仍广泛,但厚度较术后4周有了明显的降低;术后26周,纤维组织主要分布于骨缺损中心区域,其他区域不明显,其厚度较术后4、13周进一步降低。
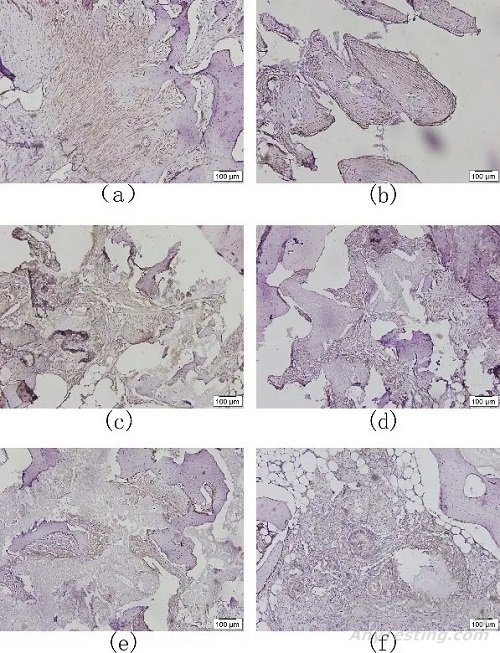
注:a为术后4周的实验样品;b为术后4周的对照样品;c为术后13周的实验样品;d为术后13周的对照样品;e为术后26周的实验样品;f为术后26周的对照样品
图4 实验样品和对照样品的免疫组化结果(α-SMA染色)
2.2.3 成骨细胞数量(软组织HE染色)
样品组与对照组各取4只动物,于病理组织切片后进行观察,并于每只动物的骨缺损区域随机取5个视野,在400×下,进行成骨细胞计数,取平均值,结果见表1~3。本研究中,无论是样品组还是对照组,早期成骨均活跃, 植入术后4周时缺损区材料周边均可见新生骨小梁周边的成骨细胞分布,见图5。
表1 术后4周的成骨细胞数量
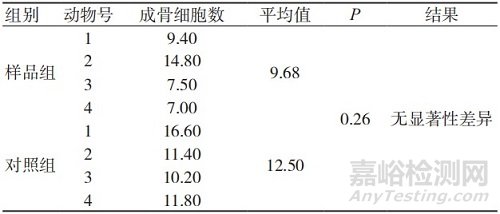
表2 术后13周的成骨细胞数量
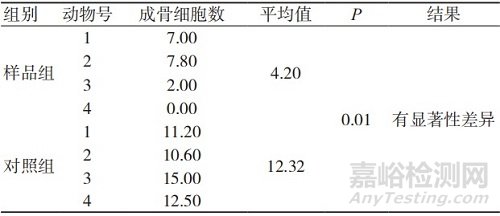
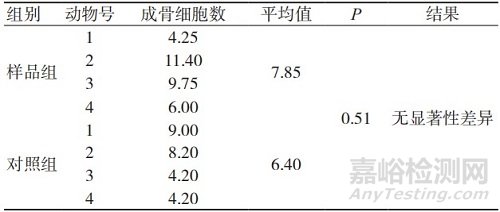
表3 术后26周的成骨细胞数量
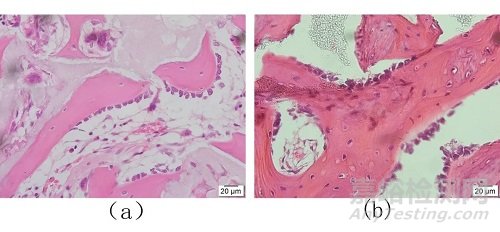
注:a 为实验样品 400×;b 为对照样品 400×
图5 植入术后4周实验样品和对照样品新生骨中成骨细胞观察结果(HE染色)
2.2.4 骨形成(甲苯胺蓝染色)
以甲苯胺蓝染色后进行的骨形成评价结果见表4~6及图6。在行甲苯胺蓝染色后,缺损区域呈现3种颜色,其中植入材料为黑色,骨组织为蓝色,其余区域为白色;采用图像分析软件Image-Pro Plus 6.0分别统计出3种颜色的面积,可帮助观察新骨的形成。
表4 术后4周的新骨形成百分比
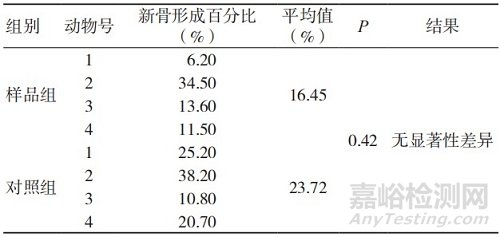
表5 术后13周的新骨形成百分比
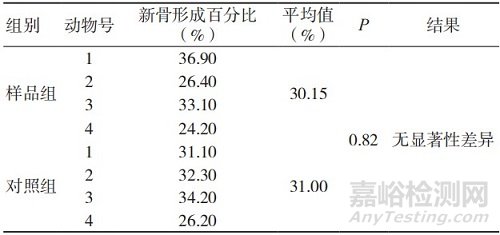
表6 术后26周的新骨形成百分比
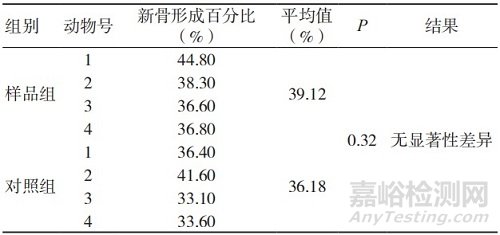
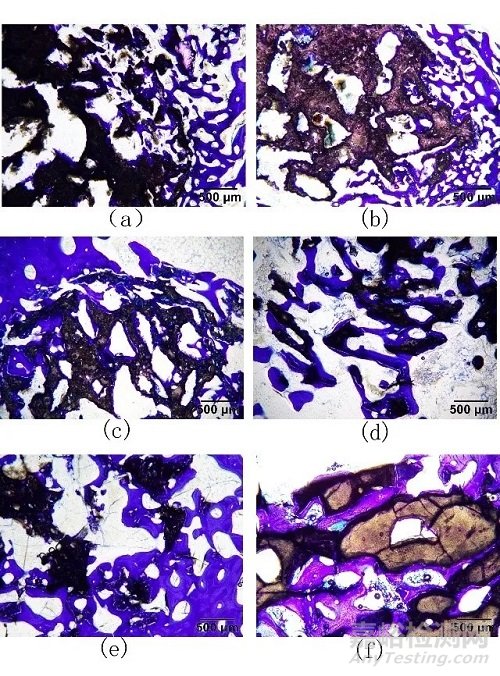
注:a为术后4周的实验样品;b为术后4周的对照样品;c为术后13周的实验样品;d为术后13周的对照样品;e为术后26周的实验样品;f为术后26周的对照样品
图6 实验样品和对照样品新骨形成结果(甲苯胺蓝染色)
组织病理学观察表明,植入术后4周,实验样品和对照样品的新骨形成主要集中在骨缺损区域的边缘,于骨缺损区域内只能观察到极少量的新骨形成,样品组新骨形成百分比均值低于对照组,但组间比较未见显著性差异;术后 13周,实验样品和对照样品骨缺损区域内的新骨形成量均明显高于术后4周,样品组新骨形成百分比均值略低于对照组,但组间比较未见显著性差异;术后26周,实验样品和对照样品骨缺损区域内可见大面积的新骨形成,样品组新 骨形成百分比均值高于对照组,但组间比较未见显著性差异,两组动物新骨形成百分比均已接近40%。
3 讨论
骨缺损是现阶段临床中常见的疾病。自体骨、同种异体骨、异种骨是较为理想的骨修复物来源,但是这些修复植入物仍存在来源、排异、病源因子传染等问题[21-22]。人工骨因具有效果确切、质量可控、成本适宜等优点,可能是 较理想的骨修复材料[23-24]。随着生物材料科学的发展和制造技术等的进步,大量的新工艺、新材料被应用到人工骨中,但是,随之而来的在患者风险与受益上的担忧,阻碍了一些新型人工骨的上市[25-26]。因此,高效、合理地综合 评估人工骨的安全性与有效性,对于充分认识新技术带来的风险与收益、解除其上市障碍具有重要的意义[27-28]。当前,临床前动物实验仍是综合进行器械安全有效研究的重要手段之一,但是,对于如何结合临床前动物实验所能获 得的各种数据,综合评估人工骨的骨形成情况尚缺乏具体的指导[29-30]。为此,本研究参考 GB/T 16886.6-2015《医疗器械生物学评价 第6部分:植入后局部反应试验》及YY/T 1575-2017《组织工程医疗器械产品修复和替代骨组织植入物骨形成活性的体内评价指南》等标准,并结合人工骨产品的自身特点,考察影像学及组织病理研究数据对骨形成能力进行评价的适用性,对综合使用各方法进行全面的评价进行探索。
对骨缺损区域成骨面积/体积的评估,是评价植入材料成骨性能的首要任务[31-32]。传统的评价方法有:(1)通过X线检查,估算骨缺损区域的成骨面积,该方法误差较大,无法做到准确的定量分析;(2)组织病理学观察,无论采用何种染色方法,因切片受取材等过程的影响,只能单纯依靠镜下观察,同样存在误差大、无法准确定量的问题;(3) Micro-CT等可3D重建的观察方法,可从植入区的整 体角度进行比较分析,但受限于分辨力及植入材料与新生骨CT信号差异性大小等因素,当需比较的植入材料之间差异性较小时,数据之间的可比较性仍存在问题。因此,本研究将影像学与组织病理学图像分析相结合,首先通过X线及Micro-CT结果构建缺损区新骨形成及重塑在时间与空间维度上的整体印象,寻求各时点各缺损修复变化需观察的“感兴趣”区域;之后,通过对“感兴趣”区域取材组织进行甲苯胺蓝染色,计算得到新骨面积占骨缺损区域面积的百分比;最后,结合影像学与组织病理观察到的新生 骨量及分布数据,分析缺损的修复及重塑情况。通过该方法,可以较为准确地了解到各个时期、不同材料在骨缺损区域特定位置成骨量的差异,从而获得更多的数据信息,为评价材料的成骨性能提供更为可靠的依据。
材料的骨传导性是判断与比较其体内修复能力的关键[33-34]。本研究结合 HE 染色及甲苯胺蓝染色考察了在植入材料周围的骨形成情况,结果显示,植入术后4周,新骨开始在材料区域边缘形成;术后13周,新骨沿材料表面向材料区域内长入,并与材料贴合紧密;术后26周,骨缺损区域中心的植入材料内可观察到贴合紧密的新骨,说明受试样品对新骨形成起到了支架作用,具有良好的骨传导性,此外,骨缺损区域除留存未降解的部分植入材料外,材料空隙区域可见大面积成片连接的新骨形成。通过HE染色可见,在骨植入术后4周,植入材料周围炎症反应轻微,可见丰富的纤维组织及少量新生的毛细血管,新骨及材料表面可见丰富的成骨细胞排列,部分区域的材料附近可以观察到少量的破骨细胞,说明受试样品周围早期成骨即已活跃。但这些与成骨相关的信息,在X线观察及Micro-CT结果中并不能得到。
纤维组织形成是植入物组织反应评价中的一项重要指标。金属、陶瓷、聚乙烯等非降解、无孔的材料,纤维化一般只局限于材料外围,表现为形态完整规则的囊状纤维层结构,在评价中只需根据包囊壁的厚度,即可推断纤维化的程度;而羟基磷灰石人工骨等可降解、多孔的材料,随着实验周期的增加,植入材料部分降解,原有的形态结构会发生改变,纤维组织会逐渐长入材料内部,纤维化区域会与形成的新骨、骨髓组织及各种组织细胞交杂,仅依靠常规的 HE染色很难准确判断出纤维化的准确范围。本研究结果显示,植入术后4周,在HE染色下观察,由于骨缺 损区域其他组织尚未形成,纤维组织区域范围明确,而至术后13、26周,实际上已无法确定纤维化范围。为了进一步对纤维化区域进行准确的定位及定量分析,本研究尝试对骨缺损区域的病理组织进行了α-SMA染色(免疫组化),在该染色下,呈棕褐色的纤维化区域被清晰地标识。实际上,人工骨植入术后早期的纤维化可能提供了局部成骨微环境,一些修复相关的间充质干细胞可能来源于此,但是,持续的界面纤维组织形成,尤其是修复中后期,可能会阻碍植入人工骨材料被骨组织替代,不利于修复,因此,对这些纤维组织形成的追踪,在评估人工骨材料实际应用表现时值得关注[35-36]。
综上所述,针对受试材料的自身特点,设置合理的评价方法,协同各种方法,对数据进行综合分析,能够更好地反映人工骨在体内反应的全过程,并对其安全性与有效性进行公允的评价。
【参考文献】
[1]周萌萌,刘宏,郭偲.复合人工骨修复材料功能性应用进展[J].中国药师,2017,20(5):899-903.
[2]年利伟,赵建民,刘瑞.纳米羟基磷灰石复合人工骨的研究进展[J].内蒙古医科大学学报,2015,37(3):274-277.
[3]陈涛,付海洋,李岩,等.羟基磷灰石基复合骨修复材料研究进展[J].中国药事,2019,33(3):302-309.
[4]吴浩俊,谭荣雄,何艳霞,等.磷酸钙活性人工骨与自体骨颗粒环抱式植骨治疗四肢骨不连[J].中国临床解剖学杂志,2020,38(2):202-207.
[5]赵培安,沈建明,张冶,等.带旋髂深血管蒂髂骨瓣联合万古霉素BAM骨诱导人工骨治疗胫骨骨髓炎[J].浙江创伤外科,2017,22(3):484-486.
[6]岑超德,张永,罗聪,等.3D打印PLLA/β-TCP复合人工骨及组织相容性研究[J].实用骨科杂志,2019,25(4):326-332,365.
[7]林山,芮钢,胡义,等.数字化珊瑚羟基磷灰石人工骨修复兔胫骨腔隙性骨缺损 [J].中国骨与关节损伤杂志,2018,33(2):153-156.
[8]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会. GB/T 16886.6-2015医疗器械生物学评价 第6部分:植入后局部反应试验[S/OL].(2015-12-10)[2017-04-01].http://www.csres.com/detail/278215.html.
[9]国家食品药品监督管理总局.YY/T 1575-2017组织工程医疗器械产品修复和替代骨组织植入物骨形成活性的体内评价指南[S/OL].(2017-08-18 )[2018-09-01].http://www.csres.com/ detail/303301.html.
[10]Huang QL, Liu YS, Ouyang ZX, et al.Comparing the regeneration potential between PLLA/Aragonite and PLLA/Vaterite pearl composite scaffolds in rabbit radius segmental bone defects[J].Bioactive Materials, 2020,5(4): 980-989.
[11]罗婷苑,张森林 .珊瑚羟基磷灰石联合浓缩生长因子修复兔颅骨缺损[J]. 医学研究生学报,2017,30(4):376-379.
[12]王超民,刘铁坚,宋振华,等.离体灭活多孔骨瓣结合BAM骨诱导人工骨修复大鼠颅骨缺损的效果评价[J].南方医科大学学报,2018,38(6):748-754.
[13]陈浩东,姚金凤,梁志刚.磷酸钙的固有骨诱导性及其应用[J].中国组织工程研究,2016,20(25):3785-3792.
[14]辛雷,苏佳灿.人工骨修复材料的现状与展望[J].创伤外科杂志,2011,13(3):272-275,284.
[15]Yu YK,Wang Y,Zhang WD, et al.Biomimetic periosteum-bone substitute composed of preosteoblast-derived matrix and hydrogel for large segmental bone defect repair[J].Acta Biomaterialia, 2020.
[16]张月,王瑾,刘克达,等.纳米羟基磷灰石/胶原复合材料在口腔骨缺损中的应用及研究进展 [J].中国实用口腔科杂志, 2020,13(6):375-378. [17]全君杰,罗刚,李志容,等.丝素蛋白/壳聚糖/羟基磷灰石膜具有好的生物相容性及促成骨性能[J].分子影像学杂志,2020,43(3):543-547.
[18]邬波,柳椰,马旭,等.3D打印胶原/羟基磷灰石支架对骨髓间充质干细胞成骨分化的作用研究[J].中华老年骨科与康复电子杂志,2020,6(3):123-127.
[19]方依婷,曾艳,张星宇,等.两种羟基磷灰石成骨能力的对比研究[J].解剖学研究,2015,37(4):268-269,365.
[20]鲍小刚,许国华.兔胫骨大段完全骨缺损的解剖学模型构建[J].中国组织工程研究,2016,20(24):3508-3515.
[21]方紫焱.羟基磷灰石复合材料的应用进展[J].山东化工,2020,49(9):81-82,84.
[22]孙浩远,宋科官.纳米羟基磷灰石复合物治疗骨缺损的研究进展[J].中国骨科临床与基础研究杂志,2019,11(5):300-307.
[23]高飞,闫明,朱珊珊,等.羟基磷灰石在生物材料中的应用[J].现代口腔医学杂志,2019,33(5):310-313.
[24]陈琦,李石岩,禹鑫,等.CGF复合丝素蛋白-羟基磷灰石支架对兔下颌骨缺损的修复作用[J]. 河北医学,2020,26(4):698-702.
[25]黄棣,张秀梅,徐梦洁,等.钛纳米管表面单宁酸/羟基磷灰石复合物的形成与性能表征[J].医用生物力学,2019,34(S1):62.
[26]张永霞,严亮,卢晓龙.PPC/纳米羟基磷灰石复合材料的制备及其性能研究 [J].塑料科技,2019,47(8):7-11.
[27]黄文良,邓江,苑成,等.组织工程化人工骨种植体修复兔骨缺损效果研究 [J].山东医药,2010,50(20):45-47.
[28]胡建中,吕红斌,周江南.新型羟基磷灰石人工骨对兔成骨过程影响的电镜观察[J].中国运动医学杂志,1997(3):179180,191.
[29]赵建华,廖维宏,刘鹏,等.消旋聚乳酸/羟基磷灰石/脱钙骨基质人工骨修复兔桡骨大段骨缺损的实验研究 [J]. 第三军医 大学学报,2003(21):1943-1946.
[30]赵登亮,孟秀英,贾玉萍,等.羟基磷灰石人工骨在医学中的应用[J].内蒙古医学杂志,1996(3):176-177.
[31]王翠,钱秀清.新型仿生骨材料修复山羊颅骨缺损的实验研究[J].北京生物医学工程,2017,36(1):29-36.
[32]郝剑,郝钊.骨移植材料研究进展[J].中国中西医结合外科杂志,2016,22(1):92-94.
[33]翁文杰,董天华,陈贤志,等.多孔型羟基磷灰石陶瓷人工骨的生物力学性能评价[J].江苏医药,1995(10):677-678.
[34]陈晓,苏佳灿.生物植骨材料的过去、现在和未来[J].中华创伤杂志,2015,31(7):577-580.
[35]应吕方,贾叙锋,程尹,等.硫酸钙人工骨复合培养骨髓间充质干细胞对骨诱导脊柱融合的影响[J].中国组织工程研究,2016,20(43):6396-6402. [36]苏鹏,张巍巍,余华伟,等.脂肪干细胞在人工骨支架诱导下的成骨效应[J].中国组织工程研究,2015,19(28):4493-4497.

来源:医疗装备


