您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2020-03-27 10:09
早在3月2日FDA就发布了一个指南文件允许医护人员使用NOISH认证的口罩的EUA文件,按照常规的要求NOISH认证的口罩也需要符合510(k)的要求,由于510(k)的获批至少需要6-8个月的时间,FDA才出台了这个文件。
22天之后,美国政府发现口罩的短缺还是没有缓解,因此又出台了一个新的针对于并没有获得NOISH认证的口罩的EUA文件。文件的第一页如下(大家仔细看看FDA的这只老鹰是不是和你看到的各种证书上的老鹰一样,这个是真正的FDA老鹰,但是这个老鹰一般不出场,这里顺带打个假)。

文件通篇只有7页,如果真想去走口罩EUA的厂商,一定要仔细通读一遍。我这里就拣重点的说。重点有三个:
第一:如果你的口罩满足以下两个要求(这两个要求只要满足其一即可),你就有机会去走这个应急通道。
要求一:口罩满足特定标准的要求,特定要求见下表
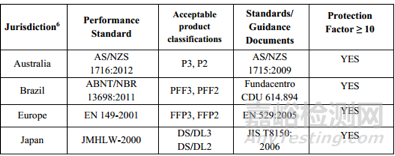
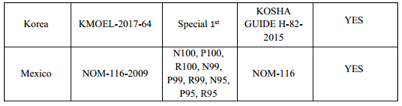
要求二:口罩有获得以下市场认证或者准入
欧盟CE认证
澳大利亚TGA认证
加拿大Health Canada注册
日本PMDA注册
其实对于国内的厂商而言我觉得有可能满足的就是要求二里面的欧盟CE认证。
第二:该如何和FDA沟通并获得该资质
该文件中也提到了你需要和FDA联系,并告知FDA一些基本的信息,比如你的口罩的型号信息,获得的证书的信息,打算销售多少口罩到美国市场去等等。FDA会进行评估,评估下来如果没有问题FDA会写邮件告诉你你们公司已经被加到口罩应急供应厂商名录下。接下来你就可以往美国市场销售口罩了,但提醒一点你还需要和你的进口商(Importer)沟通好。
第三:你还需要做什么事情
口罩厂商还需要完成以下七件事情。
制造商要将进入应急通道的口罩的英文说明书公布在公司的官方网站上,方便医护工作者查询。如有变动应及时通知FDA。
制造商还要为会接收应急口罩的医疗机构准备一份随附文件,文件内容包括制造商的名称,应急口罩的型号,预期用途以及上述的网址信息。
制造商也需要把准备随附文件的情况告知进口商,进口商应确保医疗机构有收到随附文件。
制造商应准备好不良事件上报的预案,如发生应启动预案,立即上报FDA
制造商应确保描述性印刷材料中关于口罩如何使用的信息和美国CDC的说法一致,和该EUA文件中的说法一致。如果没有特别准备描述性印刷材料表示该口罩可以安全有效地用于新型冠状病毒的防护。
制造商应保留相关的记录,包括和FDA沟通的记录,产品生产和销售的记录等等。
总结一下,符合条件的口罩厂商可以去尝试一下这个机会。但请注意口罩只能给医护人员使用,不能给普通大众使用。在尝试这个机会的时候提前和你的进口商沟通好很重要,因为口罩在美国的销售还是要依靠你的进口商的,确保进口商也了解这个政策,提前做好清关的准备。

来源:启升资讯


