您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-09-22 20:23
想必都知道碳材料各种优异的性能,但为什么碳元素能组成世界上最硬的物质金刚石,也能组成非常软的物质石墨?石墨为什么能导电而金刚石不能?碳纤维为什么强度高?炭化与石墨化你是不是傻傻分不清楚?本篇试图给大家普及一点碳材料科学基础,如果你之前没上过材料学的专业课,这篇文章可能会帮助你从更专业的眼光思考碳材料的各种问题。我尽可能不用专业词汇,而用最浅显的语言来解释这一切,如果是专业人员,这篇文章或许能帮助你重新架构碳材料知识体系。不管怎么样,漫谈碳纤维系列文章将来所谈到任何问题都是以此为基础的。想要随时复习这篇文章,赶紧点右上角分享或者收藏吧。
本文会从原子级别、晶体级别、微观级别三个尺度来了解碳材料。
首先是原子级别。物质是由原子组成的,这个不用多说,原子又是由原子核和核外电子组成,核外电子围绕原子核旋转,就像地球围绕太阳转一样。原子核是由质子和中子组成,这个不需要太了解,你只需要知道根据质子的数量不一样,分成不同的元素。比如质子数为1的是氢、质子数为2的是氦,那么碳元素在元素周期表上排第6位,它的原子核内就有6个质子,而核外电子数量又是和质子数相同的,那么碳原子就有6个核外电子。原子全部重量就集中在原子核内,而电子重量几乎忽略不计,但可别小看了核外电子,它可是决定着原子如何组成物质的关键,不同的物理化学性质都起源于它。
核外电子在原子核周围旋转可是有一定规律的,它是按照距离原子核不同距离的轨道上运动的。就像太阳有八大行星(冥王星已经被开除了),各个行星根据距离太阳远近分处不同的轨道。但原子核外电子轨道与太阳系行星轨道不同的是,距离原子核最近轨道可以放两个电子,再远一点的轨道可以放8个电子,更远的轨道我们就不说了,因为我们只关心碳元素。这样就知道了碳原子是由碳原子核和6个核外电子组成,而且碳原子最内层有两个电子,次外层有4个电子,看图示1。
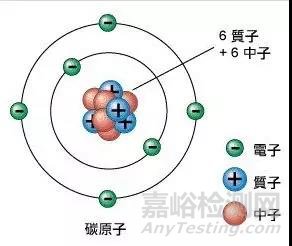
可是不是说可以放8个电子吗?放不满怎么办?放不满的话,那就不稳定,不稳定怎么办?那就想办法稳定,什么办法?跟周围原子分享电子,这样就稳定了,两个电子就被绑在一块了,这就叫共价键,想要把两个电子分开,就需要费很大能量打断这个共价键。一个碳原子跟周围四个碳原子分别形成一个共价键,四个共价键相互排斥,在空间上形成最大的角度,每两个共价键夹角109°。于是就形成了我们常看到的金刚石的原子结构如图示2。
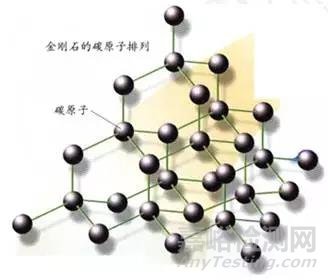
大家可以把碳原子看成小球,共价键是连接小球的刚性杆,如果要移动任何一个小球,都会牵扯周围的小球移动,所以除非把连接小球的刚性杆扯断,否则你是不容易移动小球的,这就是为什么金刚石非常硬了。明白了吧,材料学中任何材料表现的各种性能都有其内在关联的。另外碳原子核外电子与周围碳原子形成共价键了,电子被固定在两个碳原子核之间,不能自由移动,即使外加电压也不行,那么就形不成电流,也就是金刚石不导电。
这位客官问了,那为什么还有石墨那种六角平面结构呢?回答这个问题之前先端上石墨六角平面结构的图片吧,说的再好也不如图片直观。看图3.
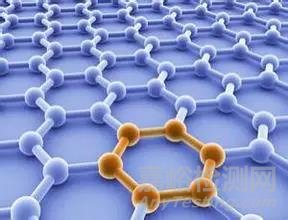
不是碳原子有4个核外电子吗?不是形成8个电子才稳定吗?不是与周围4个碳原子形成共价键才能解决问题吗?这图上碳原子只和3个碳原子形成共价键,你以为我不识数啊,这个骗子。客官先稍安勿躁,我忘了给您介绍一个原理了,这就是能量最低原理。山上石头为什么会往下滚,桌上物体为什么会往下掉?就是因为万物总会自发的从高能量向低能量转换,然后将剩余的能量释放出来,山上石头河桌上物体能量高,于是自发向下掉,剩余能量就转化成砸在地面的坑,这个解释可以理解吧。
石墨结构中两个相邻碳原子距离近,所以能量低,别问我为什么,你只需要记住石墨这种碳原子在一个平面与其他三个碳原子形成共价键,每两个共价键夹角都是120°,这样的结构能量最低。有人说了,那金刚石结构中碳原子也可以靠近距离啊,哎~这个臣妾做不到啊,因两个碳原子靠近会受到其他原子的排斥力。是不是很纠结,那石墨结构碳原子为什么能靠近啊,建议各位在纸上画一画两种结构图,石墨碳原子共价键夹角120°,有足够的空间靠近,金刚石共价键夹角109°,没空间了。空间感差的孩子要撞墙了,别着急,你只需要记住石墨这种结构是最稳定的结构。那又出现一个问题,这么说金刚石能量高,可以自发的向石墨结构转变了,赶紧把家藏的钻石卖了吧,万一哪天拿出来成石墨了,多不划算啊。这个担心就多余了,我兜里硬币怎么不往地上掉?硬币在我兜里也没在地上能量低啊,那是因为得有能量使硬币从兜底跳到兜口才能掉出来,我如果大蹦大跳,给硬币能量,说不定就掉出来了。同样,金刚石虽然不稳定,但是它是长期存在的,这叫亚稳态,只有赋予能量才能自发从金刚石转换成石墨结构,你把金刚石放到高温下,慢慢就会转变成石墨了,不信可以试一试,不过别叫我赔。
再来看石墨这种结构吧,一个碳原子与周围三个碳原子形成共价键,那剩余的一个电子就游离在这个平面的上面或下面,每个碳原子就有一个多余的游离电子,这就是石墨烯结构。碳原子稳定了,对游离电子束缚小了,加上电压游离电子就会非常迅速的定向移动,这就是为什么石墨烯属于超导材料,导电率非常好,几乎没有电阻,这也是石墨材料为什么会导电的原理。另外碳六角平面上一层电子,能吸收可见光,这就可以解释为什么石墨是黑色的了,光线照射在石墨上,被吸收了,就是黑色。
说完原子尺度,再来看晶体尺度。什么是晶体?材料学中,原子按照一定规律周期型排列就是晶体结构。看看金刚石结构,都是一个碳原子与周围四个碳原子形成正立方体的结构周期性的排列,看看石墨结构,都是碳原子与周围三个碳原子形成六角网格,然后周期性的重复,这就是石墨晶体。石墨材料呢又都是有这样的六元网平面一层一层叠起来的,两层六元网平面之间是靠游离电子相互吸引堆垛起来的。这个结合力是非常弱的,所以在外力作用下非常容易滑落,这就是为什么石墨可以作为润滑油的添加剂,因为两个平面可以自由滑动,起到润滑作用,这也是为什么铅笔要用到石墨,铅笔在纸上划的时候,一部分网平面被摩擦下来,粘附在纸上。
为什么碳材料可以耐腐蚀呢?你看看煤炭在地底下卖了几亿年,土壤这么复杂的环境下都不受腐蚀。你看看旧时候木头电线杆子表面都烧黑了埋在地下,就是因为表面木头烧成木炭,防止木头电线杆子烂在土壤里。这些都是因为碳材料耐腐蚀。因为碳跟其他元素结合反应活性很高,也就是说常温下很难反应,所以能耐腐蚀。那为什么碳跟氧气反应这么剧烈,煤炭容易燃烧,石墨容易氧化。这个要从燃烧的原理来讲,碳原子跟氧原子结合,需要将原来碳原子与碳原子的化合建打断,然后再跟氧原子形成化合键。因为打断碳原子与碳原子之间的化合键需要的能量比碳原子与氧原子形成化合键能量低。也就是说,碳原子与氧原子一结合,放出的能量会把周围碳原子与碳原子之间的化合建打断,这样碳原子与氧原子就会不断结合,碳原子与碳原子化合建不断被打断,这就是燃烧。
说到晶体结构,那肯定得有原子排列没有规律的吧,这就是非晶体,像无定形碳就是非晶体的。其实这都是相对的概念,世界上没有完美的晶体,即使单晶体里面也会有不按规律排列的原子。无定形碳就是碳原子排列比较杂乱,几乎没什么规律,还有的碳原子剩余不饱和的电子,也就是说没有形成稳定化合建。这样无定形碳就很容易跟氧气反应,因为氧原子首先跟没有形成化合建的碳原子结合,然后下面的燃烧就自发进行了。
再来看微观级别吧。上面说到单个晶体原子都是按规律排列的,如果整个物体都是这样有规律的排列,那就是单晶。但这样的物体很少见,大多数是由原子组成单晶的小晶粒,小晶粒再结合成物体。晶粒与晶粒之间也不一定有明显界限,可能是晶粒之间的晶界只是排列稍微杂乱了点,它们之间碳原子也是共价键连接。拿石墨组成来看,碳原子组成六元网格,然后六元网格叠加成为石墨小晶粒,石墨晶粒与相邻的石墨晶粒可能错层连接,或者网格方向错位连接就形成石墨物体。如果要施加外力将六元网格扯断,是非常难的,因为碳原子和碳原子结合共价键非常强。但若有排列不规则或某个地方缺少碳原子,那么这些地方结合力就相对较弱,裂纹就会沿着这样的地方扩展,如果用显微镜观察,石墨被拉断的端口基本上是沿着晶粒之间的晶界扩展的。
最后说说碳纤维,如果碳纤维是一个完美碳六角平面单晶的话,那么拉伸强度将达到800GPa,什么概念?T700碳纤维强度是4900MPa,也就是4.9GPa,仅有理论强度的200分之一左右。因为碳纤维内部属于乱层石墨结构,也就是说有石墨六元网格结构,但是网格平面是比较杂乱的,有缺陷存在,这就严重限制了碳纤维强度。还有六元网格的取向并非完全平行于纤维的长度方向,这个也限制了碳纤维的强度。

来源:材料基