您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-07-24 17:25
2020版《中国药典》9101分析方法验证指导原则中对准确度、精密度的相关要求仍未改变。方法验证中准确度和精密度存在怎样的关系,我们该如何理解其相关规定,本文表述下个人观点,不足和错误之处,大家批评指正。
一、名词解释
准确度:指采用该方法测定结果与真实值或参考值接近的程度,一般用回收率表示。
精密度:指在规定的条件下,同一份均质供试品,经多次取样测定所得结果之间的接近程度,精密度一般用偏差、标准偏差或相对标准偏差表示
偶然误差:是由于在测定过程中一系列有关因素微小的随机波动而形成的具有相互抵偿性的误差。
系统误差:是有某种特定的原因造成的误差,一般具有固定的方向和大小,重复测定时重复出现。
相对标准偏差(RSD):标准偏差与计算结果算术平均值的比值。
范围:系指分析方法能达到一定精密度、准确度和线性要求时的高低限浓度或量的区间。
极差:是用来表示统计资料中的变异量数(measures of variation),其最大值与最小值之间的差距,即最大值减最小值后所得的数据。
二、9101分析方法验证指导原则关于准确度、精密度的理解
9101分析方法验证指导原则中关于准确度、精密度相关数据要求列表如下:
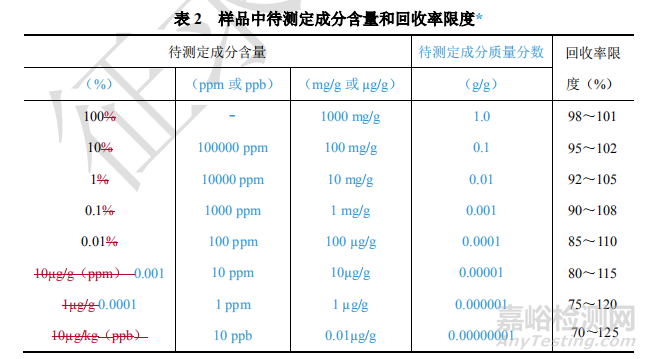
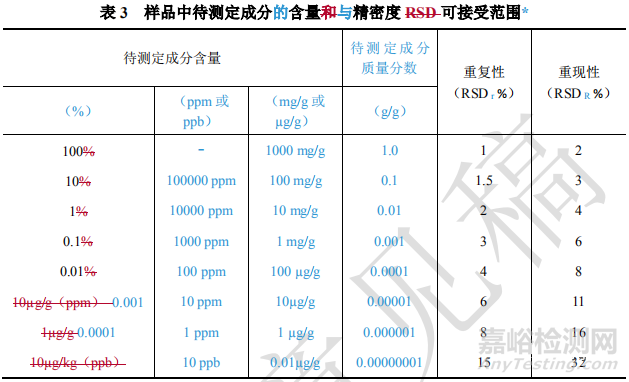
源自AOAC 《Guidelines for Single Laboratory Validation of Chemical Methods for Dietary Supplements and Botanicals》的相关要求。
上述源自《膳食补充剂和植物制剂的相关物质测定》的相关要求,化学药物研究是否适用,个人的理解如下,供参考。
|
项目 |
是否适用 |
理由 |
|
原料含量 |
是 |
/ |
|
制剂含量 |
部分适合 |
制剂存在不同的规格,但质量标准中均规定了可接受范围,而9101相关列表中规定了“待测成分的质量分数”并未明确是否考虑辅料,个人认为均应按不考虑辅料计,含量回收率均应满足为98%-101%。 |
|
原料有关物质 |
否 |
有关物质、残留溶剂等涉及药物安全性评估的检测,不同于食品相关成分的检测,差异在于药物安全性相关指标(有关、残留等)时,主成分以全部溶解的形态存在于溶液中,而食品相关成分检测时通常会采用萃取、过滤等样品前处理过程,即食品检测,检测方法的基质效应较小而药物相关杂质的检测基质效应较大(主成分对杂质测定准确度的影响),故无法满足列表相关要求。 |
|
原料残留溶剂 |
否 |
|
|
制剂有关物质 |
否 |
|
|
制剂残留溶剂 |
否 |
|
|
元素杂质检测 |
否 |
|
|
备注:9101中也注明了“在基质复杂、组分含量低于 0.01%及多成分等分析中,精密度限度可适当放宽”。我们应基于药典9101相关理念,制定适合药物质量研究相关方法验证的SOP,不可教条的理解相关内容。 |
||
分析方法的准确性和精密度分别代表方法的两个重要属性,两者之间的关系为方法的精密度好,准确性不一定好;方法的精密度不好,准确性肯定不好。准确度的偏离是方法的偶然误差,系统误差共同作用的结果,精密度的偏离,是方法的偶然误差作用的结果。
三、分析方法准确度与精密度的关系
基于质量标准相关要求,分析方法准确度的范围应小于质量标准要求的范围,如某制剂质量标准中要求其含量应为标示量的95.0%-105.0%,通常分析方法的准确度应控制在98.0%-102.0%之间;分析方法的精密度的(以RSD%计)要求,通常不得大于准确度的范围要求,如某方法的准确度要求在98.0%-102.0%之间,其方法的回收率的RSD最好控制在1.0%以内。
实例
|
序号 |
吸光度(X) |
X2 |
|
1 |
0.4444 |
0.1975 |
|
2 |
0.4421 |
0.1955 |
|
3 |
0.4498 |
0.2023 |
|
4 |
0.4452 |
0.1982 |
|
5 |
0.4431 |
0.1963 |
|
6 |
0.4412 |
0.1947 |
|
总和 |
2.6658 |
1.1845 |
|
极差 |
0.0086 |
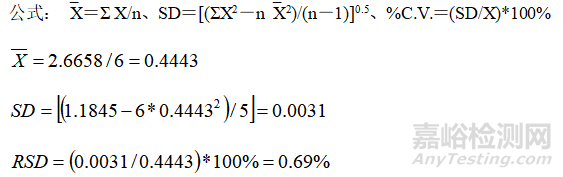
回收率的范围要求为98.0%-102.0%,即100% ± 2%(0.4443 ± 0.0089),极值为0.0086(<0.0089)在±0.0089%的范围,因此分析方法的精度控制在准确度要求的一半较为合理。
理论1:色谱系统偏差的引入
USP621中关于系统适用性精度的要求,RSD%=KB√n/t90%,n-1,RSD为相对标准偏差,K为常数0.349,B为各论中给出的上限减去100%(引申为含量的范围要求),n为参考溶液重复进样的次数(3 ≤n ≤6),t90%是在n-1自由度90%的概率下的一组t值(双侧)
相对标准偏差要求
|
|
进样次数 |
||||
|
B(%) |
3 |
4 |
5 |
6 |
9 |
|
2.0 |
0.41 |
0.59 |
0.73 |
0.85 |
1.13 |
|
2.5 |
0.52 |
0.74 |
0.92 |
1.06 |
1.41 |
|
3.0 |
0.62 |
0.89 |
1.10 |
1.27 |
1.69 |
|
... |
|
|
|
|
|
|
20.0 |
4.1 |
5.9 |
7.3 |
8.49 |
11.26 |
详细计算过程如下(以B为2.0,进样次数为6为例)
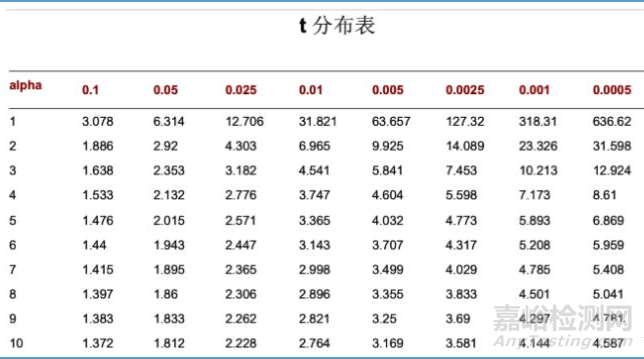
备注:双侧90%(0.1)即单侧95%(0.05)
|
K |
B |
√B |
N |
t90%,n-1 |
RSD |
|
0.349 |
2 |
1.414 |
6 |
2.015 |
0.85 |
由上述公式可知,液相色谱系统适用性的精度要求与含量范围(引申为准确度范围)的关系与进样次数有关,以方法验证回收率(n=9)为例,若回收率范围要求为100%±20%,则回收率的精密度RSD%应控制在11.26%以内,考虑到该公式的适用范围,如配样引入的误差等,该要求可能需要适当放宽,但不能超过准确度的范围要求。
理论2:基于浓度的实验规律
美国药典论坛PF39(6)<1200>Requirements For Compendial Validation中规定回收率=100%±2C-0.15,方法的重复性(interlaboratory precision),RSD=C-0.15 ,重现性:RSDR=2C-0.15,
该公式为Fitness function函数,描述的食品相关检测中分析物浓度C与分析精密度(RSD)之间关系,其出处为
基于上述规律,药物研究方法验证中,若准确度要求回收率80%-120%(数据在100% ±20%范围内),方法的精密度应控制在10%以内。
基于上述理论1和理论2,测定方法准确度与精密度的关系为方法的精密度应控制在准确度范围要求的一半较为合理,在不同实验室进行方法的重现时,其方法的精度要求可适当放宽1.5-2倍,但不得超过2倍。
参考文献
[1] USP<1225>
[2] USP<621>
[3] ICHQ2(R1)
[4] The horwitz ratio: a useful index of method performane with respect to precision

来源:药事纵横


