您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2018-08-24 17:15
一 原子结构

壁虎是一种无害的热带爬行动物,是一种非常迷人的特别动物。它的脚具有非常强的黏性,几乎可以抓住任何表面。有了这一特征,它们可以在垂直的墙壁和水平的天花板上快速爬行。实际上,壁虎可以用一根脚趾支撑其整个身体。这种非凡的能力的奥秘在于壁虎的每个趾垫上都有数量非常庞大的小绒毛。当这些绒毛接触到表面时,绒毛分子与表面分子间产生微弱的吸引力。这就是为什么壁虎能在平面上抓得如此紧。要放松抓力,只要简单地弯曲脚趾,使绒毛远离表面即可。
利用这种附着力原理,科学家们已经研发出若干种超强的人工粘着剂。其中一种是胶带,这是非常有前景的工具,可在外科手术中替代缝合线与扣钉来愈合伤口。这种材料在潮湿环境中并且它的分解不会释放有毒物质。
从一些实例中了解固体原子键结合键的一个重要益处是几何键的类型可以有助于解释材料的性能,例如碳,它可以以石墨或金刚石的形式存在。石墨相对较软,并有一种油滑的感觉,而金刚石是公认的最坚硬材料。此外,金刚石和石墨的电性能是不一样的:金刚石是不良导电体,但石墨是非常好的导体。这些性能的差异在于石墨中有一种原子间的结合键,但这种原子键结合键不存在与金刚石中。
(一)概述
固体材料的一些重要性能取决于分子中原子几何排列,也取决于这些原子和分子间的相互作用。本文介绍一些基本与重要的概念——原子结构、原子与周期表中电子组态以及不同类型原子聚集在一起构成固体。
(二)原子结构
每个原子均由一个原子核和及其周围持续运动着的核外电子构成。原子核是由质子和中子组成的。电子与质子均为带电粒子,所带电荷大小为1.602×10-19C,其中电子带负电而质子带正电,中子呈电中性。这些亚原子粒子的质量极小;质子和中子的质量相近;远远大于电子质量。
金属和陶瓷的结构

材料的性能与其晶体结构息息相关。例如未变形的纯镁和纯铍有相同的晶体结构,它们比像金和银这样的有另一种晶体结构的未变形的纯金属更易碎。此外,具有相同组成的晶体和非晶体材料存在明显的性能差异。例如非结构陶瓷和聚合物通常是透明的,相同材料的晶体往往倾向与不透明的或者最多是半透明的。
(一)概述
本文要讨论的是材料结构的下一层次,特别是固态中原子的排列。在这个框架下,引出晶体和非晶体的概念。结晶固体是由晶体结构的概念呈现出的,再由晶胞的概念详细说明。金属中有3种常见的晶体结构,由晶体、晶向和晶面具体表示。单晶、多晶以及非晶材料也会讨论。
固体材料可以通过原子或离子的排列规律进行分类。晶体材料是在较大原子距离范围内,原子进行周期性重复排列而形成的,即长期有序的排列,在凝固过程中,原子将它们自己重复排列在三维模型里,且每个原子与其最近邻的原子键合。所有的金属、大多数的陶瓷材料以及某些聚合物在正常凝固过程中都会形成的晶体结构。
结晶固体的有些性能取决于材料的晶体结构,即原子、离子或分子在空间排列的方式。有非常多的而不同种结晶都具有长程有序的原子排列,从金属这种简单的结构到像一些陶瓷和聚合材料这种极其复杂的结构。在描述晶体结构时,原子通常被看成具有已知直径的实心球,因此被称为原子硬球模型。此模型中,球代表最近邻相互接触的原子。在这种特定情况下,所有原子都是相同的。有时稳重用术语点阵来表示晶体结构,这里点阵指以点代表原子位置的一个三维点阵。
(二)晶胞
晶胞固体中的原子顺序表示小原子群形成的重复模型。因此,在描述晶体结构时,通常将结构分为许多小的重复单位,称为晶胞。大多数晶体结构的晶胞为具有3组平行面的平行六面体或棱柱体。因此,晶胞是晶体结构的基本结构单元或建筑基石,并且可以通过晶胞的几何形状和原子位置决定晶体结构,为了方便,通常规定平行六面体的角与硬球原子中心位置一致。此外,在一个特定的晶体结构中也许不只是单一的晶胞,但是我们通常用具有高度几何对称的单位作为晶胞。
(三)金属晶体结构
数目和位置没有太多限制,这使大多数金属晶体结构具有较多的最近邻原子和较密的原子堆积。对于金属我们同样用硬球模型来表示它的晶体结构,每个球代表一个离子中心。在大多数常见金属中可以发现有3种相对简单的晶体结构:面心立方结构、体心立方结构和密排六方结构。
(1)面心立方晶体结构
在许多金属中可以找到原子位于立方体中各个角和各个立方面中心的晶胞所构成的晶体结构,称为面心立方晶体结构。一些熟悉的结构如铜、铝、银、金具有这样的晶体结构。这些硬球或离子中心彼此挨着排在面对角线上,立方体边长a和原子半径R的关系表达式为:

有时我们需要确定每个晶胞的原子数。原子数取决于原子的位置,它可能与相邻的晶胞共用一个原子,也就是说,一个原子只有一定比例分配给特定的晶胞。例如,立方晶胞中,晶胞内的原子完全属于这个晶胞,而在面上的原子与另一个晶胞共用,在角上的8原子都要与其他的晶胞共用。每个晶胞的原子数N可以用下面的公式计算:
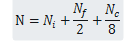
式中,![]() 为心部原子数;NF为面上原子数;Nc为角上原子数。
为心部原子数;NF为面上原子数;Nc为角上原子数。
对于FCC晶体结构来说,有8个角原子(NC=8),6个面原子(Nf=6),并且没有心部原子(Ni=0)。因此由公式(3.2),有:
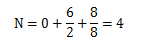
也可以说有4个原子可以分配给一个指定的晶胞,在立方体的限制下,只有部分球表示出来。晶胞所包含立方体的体积由各角原子中心围成。
角位置和面位置更是相同的,即将立方体的角从最初的角原子转换为面中心的原子,不会改变晶胞的结构。
晶体结构的其他两个重要性质是配位数和致密度。金属中每个原子都有相同的邻近原子数或接触的原子数,这就是配位数。面立方体的配位数是12.正面的面心原子有4个邻近的角原子,前面、后面各有四个面心原子与之相接触。
APF是一个晶胞中所有原子球体积总和除以晶胞体积,即:

具有相同直径的球在最大堆积可能情况下,FCC结构原子致密度为0.74.APF的计算也出现在例题里。
(2)体心立方晶体结构
另一种常见金属的晶体结构时体心立方晶体(BCC)结构,该结构晶胞的8个角各有一个原子和一个立方体中间的原子。中心原子和沿体对角线的角原子相互紧密接触,由此可找出晶胞边长a与原子半径R的关系为:
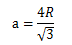
每个BCC结构晶胞有两个原子:一个原子来自于八个角,每个角的原子由8个晶胞共用,还有一个单独在晶胞内的中心原子。另外,角原子位置与中心原子位置是相同的。每个BCC结构原子数是:
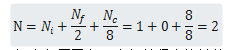
BCC晶体结构的配位数是8,每个角原子有8个与其紧密接触的角原子。由于BCC结构的配位数比FCC结构的少,所以BCC结构的原子致密度较小的0.68而不是0.74.
(3)密排六方晶体结构
并不是所有金属的晶胞都是对称立方体,最后讨论的常用金属晶体结构时具有六方晶体结构的晶胞。晶胞的顶面和地面由7个原子组成,一个原子在中间,6个原子围绕着它形成规则六边形。夹在晶胞顶面与底面中间的面由3个额外的原子组成。中间面的原子与相邻两个面原子接触。为了计算每个HCP晶体结构晶胞的原子数,将式变形为:
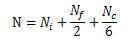
即每个角原子的六分之一将分配给这个原子。因为HCP结构的每个顶面和底面都有6个角原子,2个面心原子,和3个中间心部原子,可得出HCP结构的N值为:
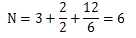
因此,每个晶胞有6个原子:
如果用a和c分别表示晶胞短边和长边尺寸,c/a的比例应为1.633.但是,有些HCP结构金属的c/a比例会偏离此理想值。
HCP晶体结构的配位数和原子致密度与FCC结构相同,分别为12和0.74.HCP结构的金属有镉、镁、钛、锌。
(四)密度计算——金属
金属固体的晶体结构可以通过以下推导公式计算理论密度:
金属理论密度
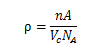
式中,n为每个晶胞中原子的数目;A为原子量;Vc为晶胞体积;NA为阿伏伽德罗常数。

来源:嘉峪检测网


