您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-08-07 19:50
案例概述
克林霉素和利福平联用是治疗骨关节感染的常见方案,但利福平作为强CYP3A4诱导剂(克林霉素主要经CYP3A4酶代谢清除),可能会显著降低克林霉素的血药浓度。本案例采用两项临床试验的124例患者、518份血浆样本数据建立克林霉素与利福平联用的群体药代动力学(PopPK)模型,量化利福平对克林霉素清除率和生物利用度的影响;并进一步模拟和评估不同给药途径(口服、间歇输注、持续输注)和给药剂量下克林霉素的PK/PD目标达成率。以探索克林霉素与利福平联合用药时,合适的给药剂量和给药途径。
案例研究流程
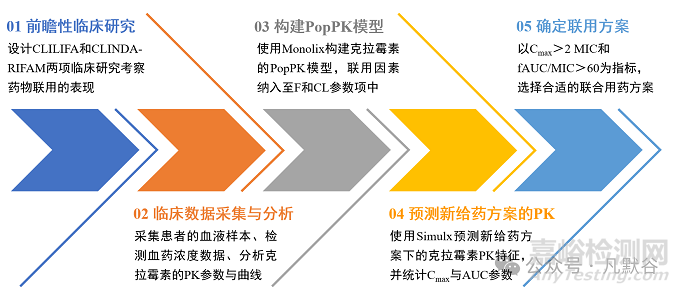
案例研究流程图

研究方法示意图
1研究背景
由于利福平可增强对生物膜内细菌的渗透,而克林霉素抑制蛋白合成,因此两者常联合用于治疗革兰氏阳性菌(如金黄色葡萄球菌)引起的骨关节感染。但克林霉素会由于利福平诱导CYP3A4活性而过多代谢,导致克林霉素的血药浓度显著下降,两者联用时会表现出药代动力学(PK)间的相互作用(DDI)。既往研究表明口服克林霉素与利福平联用时会存在疗效不足的现象,但静脉给药(尤其是持续输注,ci)可能克服这一问题,而间歇输注(ii)的可行性尚不明确。
由于目前还没有充足的临床研究数据支持克林霉素给药方案的调整,因此本研究使用前瞻性临床研究所获得的数据建立克林霉素和利福平联用时的PopPK相互作用模型,以揭示利福平对克林霉素PK参数的影响情况,并进一步用于评价不同的剂量方案、给药途径能否达到合适的克林霉素血药浓度。
2材料与方法
2.1 临床数据
纳入两项前瞻性临床研究数据(CLILIFA和CLINDA-RIFAM)进行建模分析,其中CLIRIFA共纳入39名患者(20例为单药治疗,19例为联合治疗),CLINDA-RIFAM 纳入85名患者,总计124名受试者。共收集了518个血浆浓度样本,其中248个样本为静脉给药研究结果,270个是在口服给药后收集的;265个为克林霉素单药治疗的数据,253个为联合给药的数据;有22个样本为低于定量限(BLOQ),均为口服给药且联合用药期间的采集数据。入组患者的信息、临床研究的给药和治疗方案、血浆样本的采集与处理等细节,可参考原文描述。
2.2 PopPK建模与模拟
本研究使用Monolix® 2023R1软件(MonolixSuite,Simulations Plus公司,法国)的随机近似最大期望值法(SAEM)进行群体PK分析,使用M4方法处理BLOQ的浓度(该方法将BLOQ纳入似然计算中);使用Simulx® 2023R1软件(MonolixSuite,Simulations Plus公司,法国)进行蒙特卡洛模拟;使用R软件绘制目标达成率(PTA)图。
2.3 结构模型
对于结构模型,本研究考察了具有一级吸收、消除的一室和二室模型;残差模型考察了加和型、比例型以及混合型的模型。
每个药代动力学参数均采用指数型随机效应模型,并假设其服从正态分布,其中个体间和场合间变异分别以均值为0,方差为ω2和γ2的形式呈现。对于生物利用度,采用了对数正态分布,以确保该参数值介于0和1之间。
2.4 模型选择
模型的选择是基于似然性进行的,所采用的数值标准包括-2对数似然目标函数值(OFV)、赤池信息准则和贝叶斯信息准则(这些标准是针对每个模型通过重要性抽样计算出似然性而得出的),以及拟合优度图(例如观测值与预测值散点图、群体和个体残差图等)。
2.5 协变量分析
采用逐步法(包括前向纳入和逆向剔除)对年龄、体重、性别、肾功能和肝药酶水平进行了检验。如果某个协变量导致前向纳入过程中OFV至少下降3.84个百分点(p < 0.05),或导致逆向剔除过程中OFV至少增加6.63个百分点(p < 0.01),则认为该协变量具有显著性影响。
利福平对克林霉素PK参数的影响是以分类协变量进行研究的,相应的模型公式如下:
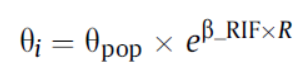
θi和θpop分别是参数θ的个体值和群体典型值,β_RIF是相应的影响因子(R=1是克林霉素与利福平联合用药,R=0则是克林霉素单独给药的场景)
利福平剂量依赖性因素对克林霉素PK的影响也进行了研究,采用的模型公式为:
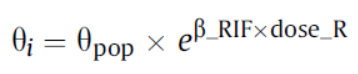
β_RIF和dose_R分别表示利福平给药剂量和利福平每次给药间隔的效应。
为了研究利福平对克林霉素生物利用度的影响,使用了以下的方程:
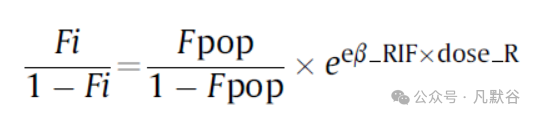
Fi和Fpop分别是生物利用度的个体值和群体典型值。
2.6 模型评估
最终模型的评估是通过图形方法进行的,例如随着时间推移的归一化预测分布误差以及预测校正的可视化预测检验。归一化预测分布误差和预测校正的可视化预测检验通过1000次蒙特卡罗模拟生成的。
采用非参数化的自举法来检验最终模型参数的稳健性。通过从原始数据集中进行重采样,生成了200个自举数据集,将自举估计值的中位数值以及2.5至97.5百分位数与最终模型的估计值进行了比较。
最后,还对模型进行了外部验证。该验证采用了另一项临床试验的数据,此试验旨在研究利福平对口服克林霉素在类似患者中的PK影响(文献报道结果)。
2.7 目标达成率
通过蒙特卡罗模拟法(使用最终模型)并结合最低抑菌浓度(MIC)值,确定克林霉素不同给药方案的 PTA(每日剂量范围从1800 mg到4800 mg,口服、间歇输注(1小时,q8h或q6h)或持续输注)。每种给药方案与MIC 组合,均模拟了500名患者。计算了研究方案中每个药代动力学/药效学目标的累积反应分数(CFR),并考虑了对克林霉素敏感的金黄色葡萄球菌的MIC分布情况(MIC为0.25 mg/L)。
评估了两个PD指标:克林霉素的最低浓度(即谷浓度Cmin)>2 MIC(假设骨穿透率为50%)和克林霉素游离部分的24小时曲线下面积与MIC比值(fAUC0-24h/MIC)>60(考虑克林霉素的血浆蛋白结合率为85%)。
3结果
3.1 PopPK模型
采用一级吸收和消除,并结合混合型残差的一室模型最能准确描述临床观测数据。吸收速率常数(ka)仅通过口服数据估算得到,并在模型中进行固定。下表 1列出了药代参数的平均值及其相对标准误差。
表1 群体药代参数的平均值及其相对标准差估算结果
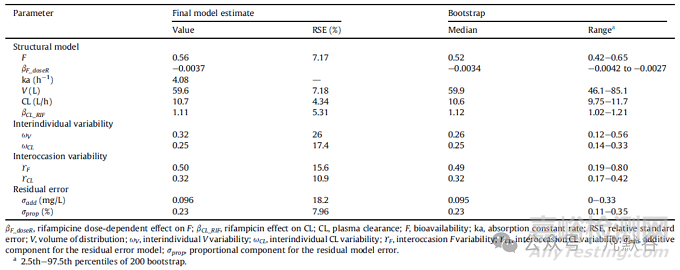
结果显示,与利福平同时使用可使克林霉素的清除率平均增加3倍。利福平对克林霉素生物利用度的影响也相当显著,并且具有剂量依赖性:当同服利福平600mg q12h和900mg q12h时,克林霉素的生物利用度将从单独给药的0.56分别将至0.11和0.04。
表1中的自举法分析结果也显示,通过自举法分析获得的PK参数中位数值与最终模型确认的估计值基本相似。
下图1的拟合优度图表明所建立的模型没有明显偏差:

图1 克林霉素PopPK最终模型的拟合优度图(a为因变量与个体预测值散点图;b为因变量与群体预测值散点图;c为群体加权残差-群体预测值散点图;d为群体加权残差vs.时间散点图;e为个体加权残差直方图;f为正态预测分布误差直方图)
图2的外部验证结果表明,口服给药后的预测效果与此前文献报道的临床研究结果基本一致。
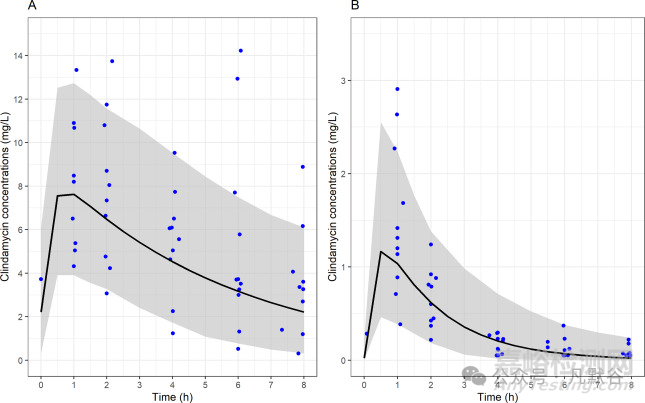
图2 通过VPC图对最终模型进行了外部验证,该验证使用了文献报道的口服给药PK数据(蓝色点表示克林霉素750mg q8h单药治疗(A)或与利福平联合治疗(B)时的克林霉素血浆浓度;黑色曲线和灰色区域分别代表预测值的中位数和90%置信区间)
3.2 CFR和PTA
克林霉素不同给药方案和给药途径的CFR和PTA,以及MIC值列于表2和图3中。这些结果表明,当克拉霉素以口服方式与利福平联合使用时,无法实现设定的PD目标。
对于通过间歇静脉输注的方式以及在与利福平联合使用的情况下,只有在使用fAUC/MIC标准,并且每日最少给予3600 mg(分三次或四次输注)的情况下,才能达到 CFR≥95%。当考虑MIC值时,该给药方案仅适用于MIC≤0.125mg/L;当MIC达到临床检测界限值0.25mg/L时,需要使用更高剂量方案(4800 mg, 1200 mg q6h)才能使得PTA为81%。对于Cmin>2MIC的标准,1200 mg q6h的剂量方案可以使得CFR为85%,PTA分别为83%(MIC为0.125 mg/L)和71%(MIC为0.25 mg/L)。
如预期所料,对于fAUC/MIC标准,采用持续输注可获得相同的CFR和PTA;而对于Cmin>2 MIC标准,持续输注的表现明显优于间歇输注。根据这一标准来看,即便每日持续输注1800 mg的剂量,在与利福平联用的情况下,也是可以达到相应指标的。
表2 考虑金黄色葡萄球菌MIC分布情况时,
克林霉素的累积反应分数
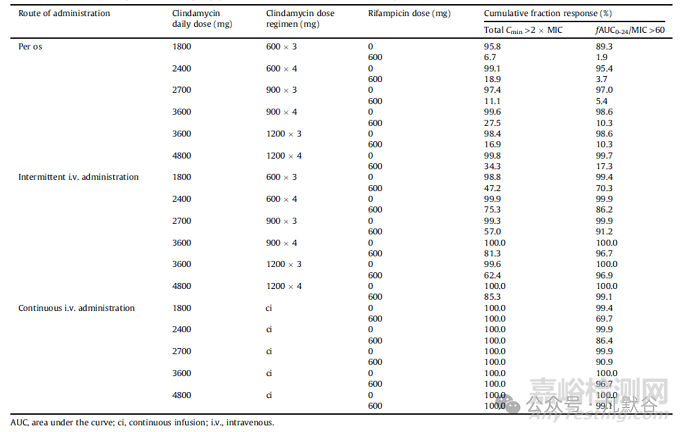

图3 根据MIC值以及不同给药方案所计算的PTA值(图中垂直虚线为针对金黄色葡萄球菌的EUCAST参考值,即0.25mg/L)
4总结
本研究通过整合克林霉素口服和静脉输注(联合或不联合利福平治疗)的数据搭建了克林霉素的PopPK模型,分别量化了利福平对克林霉素清除率和生物利用度的影响。模型估算的克林霉素平均生物利用度为56%,低于报道的原研药数值(90%);血浆清除率较健康志愿者低;而平均分布体积与健康志愿者的结果相近。经模型评估,在利福平介导的CYP3A4肠道和肝脏诱导作用下,将导致克林霉素清除率增加3倍,生物利用度降低5-15倍(取决于利福平的给药剂量)。
当克林霉素以口服给药且单药治疗时,以600 mg q8h给药即可使90%的患者达到PK/PD目标;但与利福平联合口服,则会显著降低克林霉素的体内暴露,此时无论采用哪个PK/PD目标值,CFRs均非常低,也即研究结果进一步支持两者不能以口服形式联合用药。
在使用fAUC0-24h/MIC>60的标准时,研究结果发现持续输注和间歇输注的结果是相近的。但对于Cmin>2MIC的目标,结果发现持续输注给药的PTA更高,也即持续输注可视为首选的联合用药时的给药途径。结合MIC数值,研究结果发现3600mg/d可覆盖多数患者(MIC ≤ 0.125mg/L),4800mg/d适用于更高MIC(0.25mg/L)。对于间歇输注给药,需要更高的剂量(1200mg q6h),但PTA低于持续输注给药。
由于利福平的诱导作用大约需要在连续给药10天后才能展现出来,因此在联用较高剂量的克林霉素时,治疗初期应加强治疗药物监测。此外,当前研究中没有纳入肝病或肥胖患者,导致除利福平外未发现其他相关协变量,也可能低估了体重对克林霉素PK的影响;同时也尚未评估患者的临床疗效,因此也无法得出最佳PK/PD目标的结果,后续还需进行此类研究以确定间歇输注和持续输注给药是否可以互换。
5应用软件与模块
该案例应用的软件为:Monolix®和Simulx® 2023R1软件(MonolixSuite,Simulations Plus公司,法国)
参考文献
Dosing and Route of Administration of Clindamycin Given in Combination with Rifampicin.
Sophie Magreault, et al., Clin Microbiol Infect. 2025 May; 31(5): 832-838. IF=8.5

来源:Internet


