摘要
目的 促进我国化学药生产企业质量管理能力提升。方法 通过分析 2015年至 2022年我国化学药生产企业境外检查观察情况及检查发现缺陷分布,总结境外检查重点和高频缺陷的类别。结果 2015 年至 2022年,24个境外药品监管机构对我国化学药生产企业完成443家次境外检查,发现缺陷 4854 项。2015 年至 2019年,境外药品监管机构检查家次数逐年上升,分别为 74.81.84.82102 家次;2020 年至 2022 年,受新型冠状病毒感染疫情影响,境外检查次数明显减少,分别为6,6,8家次。2015 年至 2019年,世界卫生组织(WHO)、欧洲药品质量理事会(EDOMI)、美国食品和药物管理局(FDA)检查发现的次均缺陷数分别约为 20,20,5项;严重缺陷主要由数据可靠性问题引起,但发生次数占比逐年降低。2019年,国家药品监督管理局食品药品审核查验中心共检查观察境外药品监管机构 102 家次,发现缺陷 793 项,排序前三的高频缺陷有质量控制与质量保证、文件管理、确认与验证,分别占 32.53%.14.88%.13.75%。结论 不同境外药品监管机构的检查重点及高频缺陷类别基本类似。我国化学药生产企业在质量控制与质量保证、确认与验证、文件管理等方面与国际水平仍存在差距。我国药品生产企业应根据实际情况,持续提升生产质量管理水平;我国药品监管机构应基于上述风险深入开展药品检查,促进企业质量管理能力全面提升。
随着我国科学技术的迅猛发展,以及市场发展及政府配套措施的扶助引导,医药工业转型升级,我国已形成较完善的制药产业链和产业群。众多医药企业正在走向国际化经营模式,并具备了一定的全球竞争力,越来越多的境外药品监管机构也来华进行药品检查。20世纪90年代末,我国开始了对来华进行药品检查的境外药品监管机构的相应检查观察工作。2010年前后,原国家食品药品监督管理局药品认证管理中心逐渐将境外检查观察工作制度化,我国药品监管部门也开始加速推进药品检查国际化,不断提升药品检查能力。随着境外药品监管机构来华检查的日益增加,国家药品监督管理局(NMPA)于2019年进一步完善了外检查观察的相应管理。本研究中通过分析2015 年至2022年我国化学药生产企业境外检查观察情况及检查发现缺陷分布,总结境外检查重点和高频缺陷的类别。现报道如下。
一、药品境外检查观察
当境外药品监管机构对我国人用药品进行检查时,我国药品监督管理部门会派出具有经验的药品检查员对境外药品监管机构的检查过程进行见证和记录。根据NMPA与境外药品监管机构签署的相关合作协议,境外药品监管机构派员对我国企业开展检查时,通常会通知NMPA 派出观察员进行观摩。NMPA食品药品审核查验中心(简称核查中心)具体负责境外检查观察的具体实施。当核查中心接到NMPA境外药品监管机构检查计划或通知后,会选派有资质的药品检查员作为境外检查的观察员。观察员对检查的全过程进行观察并客观记录,包括文件记录、现场情况、提出的问题和建议等,并书写观察检查报告。
二、2015 年至 2022 年我国化学药接受境外检查观察概况
2.1 总体情况
2015 年至2022年,美国食品和药物管理局(FDA)世界卫生组织(WHO)、欧洲药品质量理事会(EDOM)德国汉堡健康及消费者保护部(BGV)、巴西卫生监督局(ANVISA)等24个境外药品监管机构检查我国化学药生产企业 443 家次。
2.2 检查次数
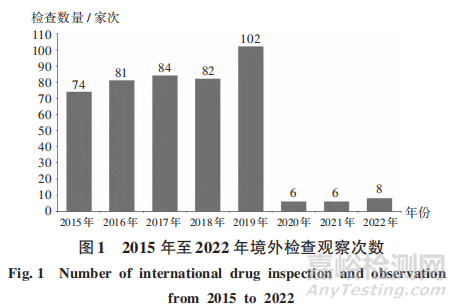
2015年至2019年,境外药品监管机构检查数量逐年增加,分别为74,81,84,82,102家次;受新型冠状病毒感染(简称新冠)疫情影响,2020年至2022年,境外检查数量急剧减少,分别为6,6,8家次,其中远程检查分别为3,3,4家次。详见图1。
2.3 检查发现的缺陷
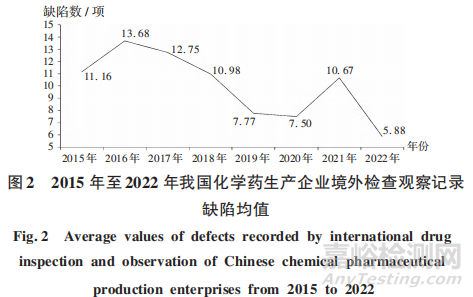
随着《药品生产质量管理规范》(2010年修订,以下简称 GMP)的深人实施,我国药品生产企业整体GMP水平不断提高。2015年至2022年,核查中心共进行443家次境外检查观察,记录缺陷4854项;境外药品监管机构检查发现的次均缺陷数呈下降趋势。详见图2。
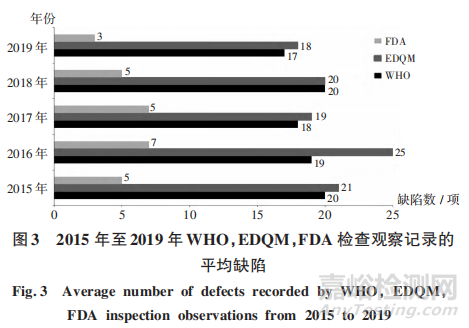
由于不同境外药品监管机构的检查员背景和专长有差异,所发现缺陷数量存在差异。2015年至2019年WHO 和 EDOM检查发现的缺陷数量相对较多,平均每次检查发现约20项,且所有问题均进行详细描述;FDA检查发现的缺陷数量相对较少,平均每次检查发现约5项,由检查员结合产品风险和发现缺陷进行综合判断后形成最终缺陷项。详见图3。
受新冠疫情影响,2020年至2022年的境外检查数量明显减少。俄罗斯联邦药物与规范研究院(SID& GP)波兰药品检查局(CPI)采用远程检查的方式进行检查FDA和 WHO 等仍进行现场检查。2020年至2022年,现场检查10次,发现缺陷87项;远程检查10次,发现缺陷44项。
2.4 检查发现的严重缺陷
2015年至2019年,境外检查发现严重缺陷的次数占比逐年降低,发现的严重缺陷主要由数据可靠性问题引起;2021年至2022年,均未发现严重缺陷。详见表1。数据可靠性问题可简单分为规范性因素和真实性因素两方面。2015年至2017年,严重缺陷主要是违背诚实信用原则故意编造、篡改数据等导致的数据可靠性问题,随着全球主要药品监管机构、国际组织和我国药品监管部门针对药品数据发布的一系列指南、法规,我国药品生产企业质量管理体系不断提高,真实性因素导致的数据可靠性缺陷逐渐被规范性因素导致的数据可靠性替代。2018年至2022年,境外检查发现的严重缺陷开始转向了无菌保障、风险评估、变更控制、防交叉污染等多个影响产品质量的关键因素。
三、2019 年化学药生产企业接受境外检查观察分析
3.1 我国核查中心检查观察情况
3.1.1 检查观察次数
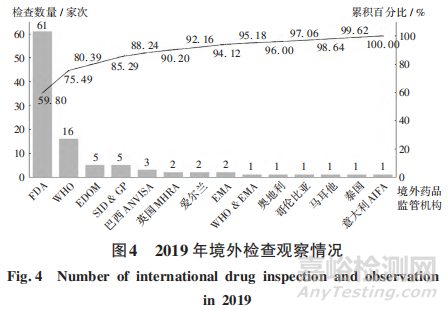
2019年。核查中心组织开展对主要包括FDA等在内的 13个境外药品检查机构的检查观察102家次,其中FDA,WHO,EDOM 3个境外药品检查机构检查观察82家次,约占全年检查观察的80.39%。详见图4。
3.1.2 检查观察发现的缺陷
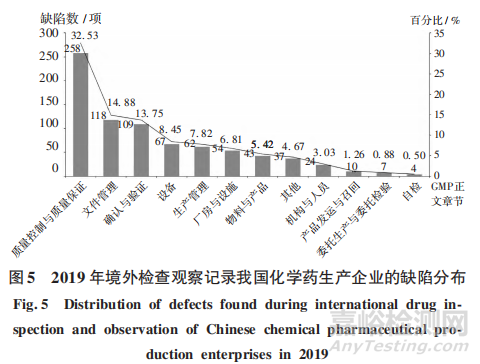
2019年,检查观察共记录境外药品检查机构检查发现缺陷793项,参照GMP正文章节对境外检查观察中记录的缺陷进行分析。其中,质量控制与质量保证文件管理、确认与验证、设备、生产管理5个类别的缺陷约占全部缺陷的 77.43%。详见图5。
3.2 境外药品监管机构检查观察情况
3.2.1 FDA
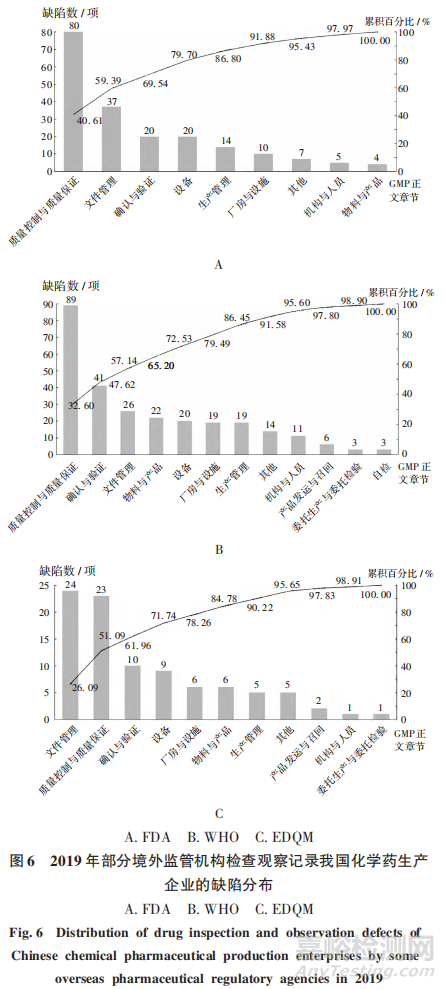
2019年,核查中心共组织FDA对我国化学药生产企业检查观察61家次,发现缺陷197项,约占2019年全部境外药品监管机构发现缺陷的24.84%,平均每次检查提出缺陷约3项。参照GMP正文章节,将FDA 检查观察中记录的缺陷分类,详见图6A。质量控制与质量保证、文件管理、确认与验证部分提出的缺陷占比分别居第1,2,3位,占比分别为40.61%,18.78%,10.15%,与2015 年至 2018年FDA在我国检查发现的情况一致。
1)质量控制与质量保证问题涉及偏差调查不充分未找到根本原因,纠正措施和预防措施(CAPA)无效变更的风险评估不完整,年度质量回顾不全面,投诉未启动调查,稳定性考察项目的方法/标准与《美国药典》(USP)不一致,仪器缺少/未开启审计追踪,检测仪器多人共用一个账户,取样不具代表性,检验的原始记录/附图不完全,质量管理部门对电子数据审核缺失等。
2)文件管理问题涉及记录的信息不完整/缺失,记录的唯一性不受控,记录未及时填写和签名,关键的探作/数据等缺少签名和复核,相关操作未建立规程等。
3)确认与验证问题涉及清洁验证不足,部分设备/器具的清洁程序未验证,工艺验证未涵盖工艺参数范围,设备确认未涵盖生产使用范围等。
3.2.2 WHO
2019年,核查中心共组织WH0对我国化学药生产企业检查观察16家次,发现缺陷273项,约占2019年全部境外药品检查机构发现缺陷的34.43%,平均每次检查提出缺陷约 17项。参照 GMP正文章节,对WHO 检查观察中记录的缺陷分类,详见图6B。质量控制与质量保证、确认与验证、文件管理部分提出的缺陷分别居第1,2,3位,占比分别为32.60%,15.02%,9.52%。
1)质量控制与质量保证问题涉及偏差未按流程调查及 CAPA 不足,偏差未定期回顾,缺少审计追踪功能或未启用,时区未锁定/各检测仪器时间存在较大差异,分析方法变更后未验证,水、环境检测、投诉、偏差等未进行年度回顾,变更未进行风险评估/未对变更前后进行对比,微生物实验室的标识、人员培训、灭菌设备等管理存在不足,未进行培养基适应性试验等。
2)确认与验证问题涉及验证未考虑最差条件,未建立(再)验证与确认计划,验证与确认未进行/部分遗漏,未进行清洁验证/清洁验证存在清洁溶剂选择错误,未考虑残留及擦拭点未评估,工艺验证不充分,溶剂回收风险评估不足,物料/中间体等制订的效期未验证等。
3)文件管理问题涉及批记录设计不全,批记录未记录偏差等异常事件,不同文件/记录不一致,规程与实际操作不一致,记录散页不受控,未及时记录和复核等。
3.2.3 EDOM
2019年,核查中心共组织EDOM对我国化学药生产企业检查观察5家次,发现缺陷92项,约占2019 年全部境外药品检查机构发现缺陷的11.60%,平均每次检查提出陷约18项。参照 GMP正文章节,对EDOM 检查观察中记录的缺陷分类,详见图6C。文件管理、质量控制与质量保证、确认与验证部分提出的缺陷分别居第1.2,3位,占比分别为26.09%,25.00%,10.87%。
1)文件管理问题涉及批记录未记录偏差等异常事件,文件规定不全/未建立相关规程,文件规定不合理/错误,记录设计不全/信息填写不全,活页记录不受控,记录编号/页码控制缺失,操作人员/复核人员未签名等。
2)质量控制与质量保证问题涉及偏差调查不彻底、评估不充分,变更未进行评估/变更未完成前已实施,年度质量回顾不全,水系统、洁净区环境等监测缺乏审查和趋势分析,新增供应商未确认,取样点未评估检测的样品不具代表性,计算机未得到适当控制等。
3)确认与验证问题涉及工艺验证考虑不全,计算机系统验证未考虑操作系统的更新问题,执行的参数效期等没有进行验证,设备验证不包括附属设施,灭菌验证温度探头放置位置不科学等。
四、建议
通过分析近年来我国化药品生产企业境外检查观察情况及缺陷分布,发现不同境外药品检查机构虽发现的具体缺陷有差异,但检查的重点及发现高频缺陷的类别基本类似,表明我国化学药生产企业在质量控制和质量保证、确认和验证、文件管理等方面仍与国际水平有一定差距,建议药品生产企业对症下药,全面提高质量管理水平。另外,基于化学药生产企业 GMP的实际情况,我国药品检查机构也应将质量控制和质量保证、确认和验证、文件管理等作为检查重点,结合化学药生产企业的具体情况,有的放矢地进行检查。
质量控制和质量保证、确认与验证、文件管理等是药品检查发现缺陷的“重灾区”。现阶段,我国相当部分的化学药生产企业以符合法规为目的、按GMP组织生产活动,但未将 GMP 作为强化自身管理的有力工具。化学药生产企业应根据自身实际,活学活用,持续提升其生产质量管理水平,最终形成企业独特的质量文化。
我国药品生产企业GMP水平参差不齐,而检查资源又相对有限。我国药品监管机构可在境外药品检查机构监管的基础上进行风险研判,聚焦检查关键性问题及高风险问题。同时,对境外药品检查机构监管发现的问题深人总结与分析,作为了解我国化学药品行业生产质量管理水平的重要手段。同时,与我国药品检查机构进行药品监管时发现的问题进行对比分析,深入了解药品的行业现状和检查现状,做到基于风险的药品检查。
参考文献
[1]黄宝斌,许明哲,白东亭,等.WHO药品预认证项目为我国药品生产企业的国际化开辟道路[J.中国医药工业杂志,2014,45(7):697-702.
[2]查玉琴,付映林,王 杰,等.制药工业的现状和发展趋势分析[J].广州化工,2020,48(6):14-16.
[3]王金库,刘 华.化学制药企业实施国际化经营的策略探索门,产业与科技论坛,2017,16(3):237-238.
[4] LIN XH, HU H, LU Y, et al. The comprehensive influence offirm- level factors on drug product internationalization ofChinese pharmaceutical firms [j]. Journal of Chinese Pharma-ceutical Sciences,2018,27(3):209-214.
[5]陆仕华,韦莹莹,李 杉,等.药品 GMP跟踪检查与认证检查缺陷对比[J].中国医药工业杂志,2019,50(1):118-121.
[6]颜若曦,曹 轶。药品生产企业数据可靠性缺陷分析[J]中国药物警戒,2018.15(1):20-23.
[7]国家食品药品监督管理局食品药品审核查验中心.国家食品药品监督管理局关于发布《2017年度药品检查报告》的公告(2018年第32号)[A/0L].(2018-06-05)[2023-03-03].http:// www. cfdi.org.cn/resource/ news/ 10430.btol.
[8]颜若曦,曹 轶,董江萍.FDA对我国药品生产企业检查分析[J].中国新药杂志,2020,29(15):1697-1701.
[9]胡位歆,和金周.国内外制药企业质量管理成熟度现状及对我国药品生产监管的启示[J].中国医药导刊,2022,24(8):740-745.
[10]孙 涛,余 泓,秦昆明.制药企业《药品生产质量管理规范》体系与企业文化协同发展研究[J,中国药业,2022.31(15):20-23.
[11]罗 潇.药品检查员队伍职业化建设研究 -基于H省药品检查工作及队伍现状实证分析[D.郑州:郑州大学,2022
[12]王 丹,欧阳楠,陈 颖.省级职业化药品检查员队伍构建现状分析[J].中国药业,2021,30(2):11-14.
[13]杨璐瑶,杨 悦。美国FDA基于风险的药品检查计划的研究与借鉴[J].中国新药杂志,2020,29(22):2535-2540
[14]黎依娴,沈 波,陈佩毅,等.基于风险的药品上市后变更现场检查要点[J.今日药学,2022,32(8):638-640.