今日头条
恒瑞MOR靶向镇痛药报新NDA。恒瑞医药1类新药富马酸泰吉利定注射液(SHR8554)的新适应症上市申请获CDE受理,推测申报的适应症为“骨科手术后镇痛”。SHR8554可激活μ阿片受体(MOR),选择性地激活G蛋白偶联通路,具有中枢镇痛效果的同时,可减轻胃肠道不良反应和减少呼吸抑制不良反应的发生率。2022年7月,泰吉利定针对“腹部手术后中重度疼痛”上市申请已获得CDE受理。
国内药讯
1.复宏汉霖PD-1单抗获批印尼上市。复宏汉霖PD-1抑制剂汉斯状®(斯鲁利单抗,H药)获得印度尼西亚药监部门(BPOM)批准上市,用于治疗广泛期小细胞肺癌(ES-SCLC),商品名为Zerpidio®。这是H药首次在海外获批上市。PT Kalbe Genexine Biologics(KGbio)公司拥有H药在东盟十国以及在沙特阿拉伯、阿联酋、埃及、卡塔尔、约旦、摩洛哥等12个中东和北非地区(MENA)国家的部分适应症独家权益。
2.益方KRAS G12C抑制剂报产。益方生物1类化药格舒瑞昔片(D-1553,Garsorasib)的上市申请获CDE受理,用于治疗KRAS G12C突变的局部晚期或转移性非小细胞肺癌。在I/II期研究中,D-1553确认的客观缓解率(ORR)为40.5%,疾病控制率(DCR)为91.9%,无进展生存期(PFS)达到8.2个月。正大天晴拥有该新药在中国大陆地区的独占性开发、注册、生产和商业化权益。
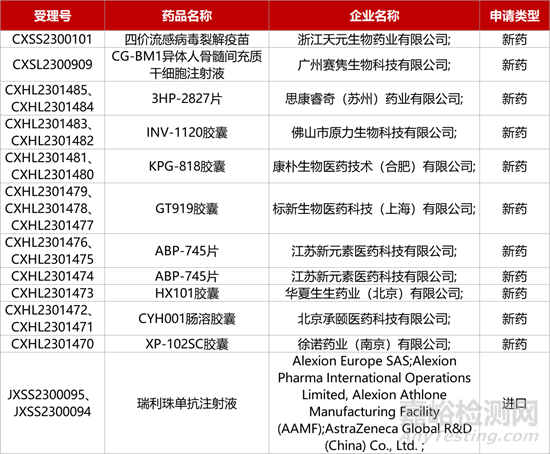
3.AZ长效C5补体抑制剂中国报产。阿斯利康补体C5抑制剂瑞利珠单抗注射液(ravulizumab,Ultomiris)的上市申请获CDE受理。该新药目前正在中国开展III期研究评估用于预防体外心肺循环时慢性肾病患者的严重肾脏不良事件的效果。在美国,该药已获批治疗多种自身免疫性疾病,包括阵发性睡眠性血红蛋白尿、非典型溶血尿毒综合征以及全身型重症肌无力。
4.礼来口服GLP-1R激动剂启动降糖III期研究。礼来GLP-1R小分子激动剂orforglipron(LY3502970)登记启动一项III期ACHIEVE-2研究,评估orforglipron与达格列净相比,用于血糖控制不佳的2型糖尿病患者的有效性和安全性。该项试验主要研究者由上海市第六人民医院医学博士贾伟平和于浩泳共同担任。II期研究(NCT05048719)26周数据显示,orforglipron组受试者A1c平均降幅高达2.1%,而安慰剂组和度拉糖肽组这一数值分别为0.4%和1.1%。
5.三叶草促血小板生成剂早期临床积极。三叶草生物1类新药SCB-219M在I期临床中获积极结果。SCB-219M 是一款创新型包含血小板生成素受体激动剂(TPO-RA)模肽的双特异性Fc融合蛋白靶向药物,用于肿瘤患者化疗引起的血小板减少症 (CIT) 。初步数据显示,SCB-219M给药一周后,所有受试者均观察到血小板计数可保持或恢复到大于75x109/L(CIT警戒线),且疗效持续长达三周;此外,药物耐受性良好。
6.康德赛巨噬细胞疗法报肝硬化IND。四川康德赛1类生物制品“CUD005注射液”的临床试验申请获CDE受理。CUD005是一种巨噬细胞疗法,可以通过分泌多种基质金属蛋白酶(MMPs)来有效降解胞外基质,减少肝脏瘢痕淤积,同时通过释放抗炎因子(IL-1RN等)来抑制炎症反应的发生,以改善肝脏炎症微环境,减缓病情发展。该新药拟开发用于治疗中晚期肝硬化。
7.上海健信两款双抗报新IND。上海健信生物两款1类生物制品注射用LB4330(Bis2)和注射用重组抗PD1/TIM3人源化双特异抗体(Bis5,LB1410)的临床试验申请同日获得CDE受理。Bis2是一款靶向肿瘤CD8+T细胞和CLDN18.2的双功能免疫治疗产品;Bis5是一款针对PD-1治疗无效和耐药病人的产品。Bis5和Bis2目前均已在中美两地同步临床开发, 并已经完成Ⅰ期剂量爬坡。
国际药讯
1.首款自体TIL疗法2024年初有望获批。Iovance公司肿瘤浸润淋巴细胞(TIL)疗法Lifileucel用于治疗晚期黑色素瘤的生物制剂许可申请(BLA)即将在2月24日获得FDA最终审批结果。去年FDA由于自身的资源限制,将Lifileucel的优先审查PDUFA日期由11月25日延长了3个月。在II期C-144-01研究中,Lifileucel的客观缓解率(ORR)达到31.4%;有41.7%的缓解持续时间≥18个月。Lifileucel有望成为首款获FDA批准用于这类患者的全新的治疗方法。
2.阿斯利康ATTR抗体启动Ⅲ期临床。阿斯利康旗下Alexion公司在Clinicaltrials.gov网站上注册ATTR抗体ALXN2220(NI006)一项Ⅲ期临床,拟评估用于治疗转甲状腺素蛋白淀粉样心肌病(ATTR-CM)的有效性与安全性。NI006旨在特异性靶向错误折叠的转甲状腺素蛋白,以清除心脏中的淀粉样纤维沉积物。12个月治疗数据显示,NI006显著减少患者心脏淀粉样蛋白沉积;未观察到明显的剂量限制性毒性或与药物相关的严重不良反应。
3.ROR1 CAR-T疗法早期临床出现患者死亡。Oncternal公司ROR1靶向自体CAR-T疗法ONCT-808治疗复发或难治性侵袭性B细胞淋巴瘤的I/II期ONCT-808-101研究出现5级(致命)严重不良事件。在ONCT-808(1x10^6)初始剂量下,3例患者中有2例获得完全代谢缓解(CMR),1例获得部分缓解(PR)。但首例接受第二剂ONCT-808(3x10^6)治疗后,患者由于胞因子释放综合征(CRS)和神经毒性综合征(ICANS)导致死亡。
4.新型减肥胶囊临床前研究积极。来自麻省理工学院、哈佛医学院和剑桥大学的研究团队开发的可以在胃内震动的可服用新型减肥胶囊药物,能通过振动调节胃部拉伸感受器来刺激迷走神经向大脑发送信号,改变与食欲有关的激素水平,从而让胃产生强烈的饱腹感。动物实验显示,在进食前20分钟服用可使动物的进食量比平时减少约40%,而且未检出任何副作用,胶囊在四五天内就能通过消化道排出体外。研究成果近日发表于《科学进展》上。
5.口服环肽药物临床前研究积极。瑞士洛桑联邦理工学院科学家开发的靶向凝血酶的口服环肽药物的临床前研究成果近日发表于《自然·化学生物学》杂志上。研究人员开发了一种两步合成策略,以合成大量具有硫醚键的环肽,提高了这些环肽在口服时的代谢稳定性。在大鼠身上测试时,口服肽药物生物利用度高达18%,有望为一系列疾病提供新的治疗选择。
6.张锋学生创办的基因编辑公司获15亿融资。Tome Biosciences公司宣布完成2.13亿美元的A轮和B轮融资(约15亿人民币),用于推进其程序化基因组整合(PGI)的新型基因编辑技术,用于精确插入任何大小的DNA序列到目标基因组位置,以开发能够在体内纠正基因的针对单基因肝病和自身免疫疾病的细胞疗法。该公司的联合创始人Omar Abudayyeh博士和Jonathan Gootenberg博士二人曾是CRISPR基因编辑先驱张锋教授的研究生,现为麻省理工学院(MIT)的研究员。
医药热点
1.上海交通大学医学院附属松江医院揭牌。12月28日上午,上海交通大学医学院附属松江医院揭牌仪式举行。上海交通大学医学院附属松江医院将充分发挥“区校共建、院校融合”体制机制优势,全面提升松江区医疗卫生整体水平,加快推进长三角一体化国家战略,为教育强国、科技强国、人才强国、健康中国贡献力量。
2.潘峰任首都医科大学附属北京地坛医院党委书记。据首都医科大学附属北京地坛医院官网显示,潘峰已任地坛医院党委书记。根据公开信息,潘峰,男,汉族,1977年生,中共党员,硕士研究生,副研究员。此前,潘峰曾任北京市医院管理局办公室副主任、首都医科大学附属北京友谊医院副院长、北京市医院管理中心办公室主任。
3.浙江全省统一特殊病种目录。近日,浙江省医保局下发《关于统一基本医疗保险门诊特殊病种范围的通知》,就统一特殊病种范围有关事项做出安排。《通知》显示,浙江将在省级层面统一病种范围,在各统筹地区现有特殊病种范围中,先行将恶性肿瘤等16种费用负担较重、适合在门诊治疗、比住院更经济方便的特殊疾病,纳入第一批省特殊病种范围。自2024年1月20日起施行。
评审动态
1. CDE新药受理情况(12月30日)
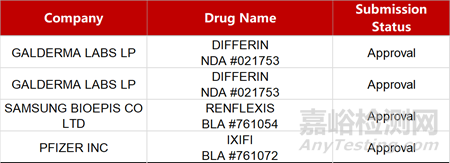
2. FDA新药获批情况(北美12月27日)