目的:对制药用水中主要微生物类型及控制措施进行分析,为制药用水系统的有效控制提供指导。方法:分析饮用水、纯化水、注射用水中主要微生物种类、丰度及其危害性,并探讨制药用水中微生物的控制措施。结果制药用水中主要微生物类型存在差异,洋葱伯克霍尔德菌复合体和皮氏罗尔斯顿菌是潜在的条件致病菌,可造成生物安全隐患。结论:制药企业可通过建立各级水系统微生物数据库及常见微生物菌种库,应基于警戒限和行动限进行趋势分析,从而加强对水系统中微生物的控制。
制药用水系统是制药行业所需的洁净公用工程系统。制药用水可以作为清洁剂,用于淋洗和清洁储罐、设备等,或作为原辅料,用于药品调配、合成与制剂生产,也可作为高压灭菌器的蒸汽供应等。制药用水的化学纯度和微生物负荷会直接影响最终产品的质量,每家制药企业都会投入大量的资源建设和维护制药用水系统[1]。根据生产工艺和应用场景的不同,药品生产工艺中使用的水,主要分为饮用水、纯化水、注射用水和灭菌注射用水[2]。虽然每一级水都有严格的质量控制体系,但是每一级水也都是微生物污染的潜在来源,因此,制药用水系统微生物负荷的控制尤为关键。在实际生产实践中,为了更好地控制制药用水系统中的微生物水平,除了通过生物负载测定微生物数量外,微生物学家还需要了解水系统中存在的微生物类型,不仅有助于明确水系统中微生物污染趋势的变化,也便于预测它们是否会导致更严重的问题,比如水系统中是否有形成生物被膜的风险,或者它们是否对产品(从而对患者)造成特殊风险[3]。
本文对制药用水系统中主要的微生物类型及其风险因素进行综述,以期为制药企业水系统的微生物控制提供帮助。
1、各级制药用水中主要的微生物种类和丰度
众所周知,淡水中的微生物多来自于土壤、空气及动植物等,但由于水体属于特殊的生境,水体中微生物的多样性往往要比陆地小很多[4]。微生物在淡水中的分布受许多环境因子的影响。简单来说,在远离人们居住地区的水体中,微生物的种类主要有自养型的硫细菌、铁细菌、球衣细菌、蓝细菌、绿硫细菌和紫细菌等菌属;而处于城镇等人口密集区的水体中,微生物主要是以腐生型细菌和原生动物为主,包括数量较多的无芽孢革兰氏阴性细菌。由于制药用水来源于外界淡水系统,因此微生物污染的背景一直存在,每个等级的制药用水都存在一定水平的微生物种类污染,尤其是在没有得到充分控制的情况下[5]。
1.1 饮用水微生物群落结构
饮用水为天然水经过氯化处理净化处理所得的水,其质量符合现行中华人民共和国国家标准《生活饮用水卫生标准》。饮用水可作为药材净制时的漂洗、制药用具的粗洗用水。除另有规定外,也可作为饮片的提取溶剂。
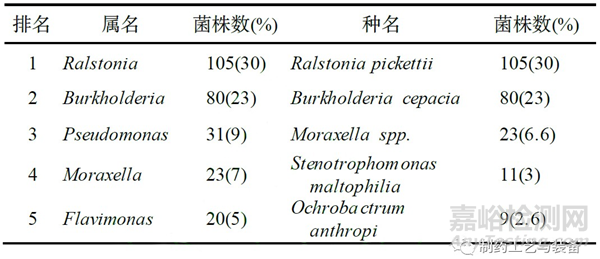
Sandle[3]从201个超过警戒线的饮用水样本中,分离鉴定出504个菌株。504个菌株中,主要属为革兰氏阴性菌,也有部分革兰氏阳性菌发现。排名前五的菌属信息见表1。从表1可见饮用水微生物中主要的3个属为Pseudomonas ,Brevundimonas 和Sphingomonas,而Pseudomonas fluorescens,Brevundimonas vesicularis 和Ralstonia pickettii 为主要的种。
表1 饮用水中排名前五的主要菌属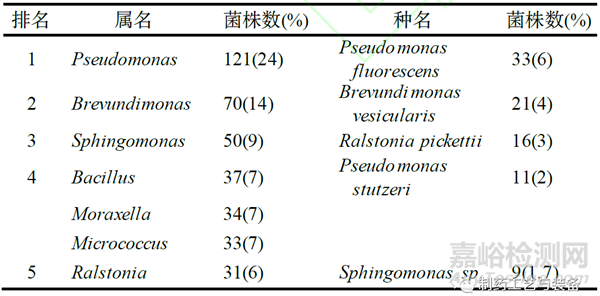
1.2 纯化水微生物群落结构
纯化水为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制备的制药用水,不含任何附加剂。纯化水可作为配制普通药物制剂用的溶剂或试验用水,也可作为中药注射剂、滴眼剂等灭菌制剂所用饮片的提取溶剂等[2]。Sandle[3]从6300个纯水样本筛选到315个超警戒线的样本(欧盟药典规定菌落数不得多于100 CFU·mL−1),并回收了347个分离株。主要属、种如表2所示。从表2可见纯化水微生物中主要的属为Ralstonia和Burkholderia,而Ralstonia pickettii和Burkholderia cepacia为纯化水中最主要的菌种。
此外,笔者在先前对核电厂的主泵轴封水系统的水体(纯化水)微生物研究发现,该纯化水中占优势的细菌为铁细菌,包括不动杆菌、假单胞菌、罗尔斯通氏菌等,以及一些其他难培养的细菌[6]。
1.3 注射用水微生物群落结构
注射用水为纯化水经蒸馏所得的水,需符合细菌内毒素试验要求。制药企业应定期清洗与消毒注射用水系统。注射用水的储存方式和静态存储期限应经过验证确保水质符合质量要求。注射用水可作为配制注射剂、滴眼剂等溶剂或稀释剂及容器的精洗[2]。
由于注射用水严格的质量控制,通常从注射用水系统中分离的微生物很少。如果水系统的管道设计可有效避免所谓的“死角”(水流中断的区域)并且水流保持连续运动状态,则污染风险会进一步降低。
Sandle[3]在15年间收集了46800个注射用水样本。研究发现,很少有注射用水样品不满足水系统的质量要求[欧盟药典规定菌落数不得多于10 CFU·(100 mL)−1]。46800个样本中只有300个样本检测到革兰氏阴性杆菌(比率为0.6%),最终回收了439个革兰氏阴性杆菌(每个样本少于2种不同的生物体)。主要的属、种信息见表3。数量上最常见的微生物种名还是Ralstonia pickettii,Burkholderia cepacia 和Flavimonas oryzihabitans。郑小玲等[7]分析了浙江省内制药企业注射用水的微生物结构,发现污染的微生物主要为革兰氏阳性菌,占污染微生物总数的60.3%,革兰氏阳性菌主要是由于外部环境控制不当特别是人员操作污染引入,因此企业注射用水系统的微生物控制不仅要关注革兰氏阴性菌风险,同时也不能忽视环境人员污染风险。
表3 注射用水中排名前五的主要菌属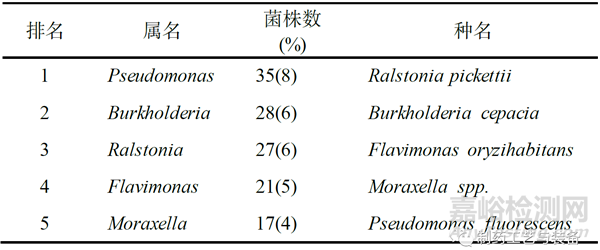
2、制药用水中主要的微生物及其危害性分析
洋葱伯克霍尔德菌复合体(Burkholderia cepacia complex,BCC)和皮氏罗尔斯顿菌是制药用水中主要的污染菌。笔者将进一步对它们能在纯水系统中生存的主要原因和危害性进行综述。
2.1 BCC
BCC因引起洋葱患病而得名,实际上它可以感染植物界及人类,具有较强跨界感染能力,可以使患有囊性纤维化和慢性肉芽肿性疾病的患者引起严重的“洋葱伯克氏菌综合症”致死。免疫功能低下患者(虚弱的老年人、HIV 阳性者、接受化疗的癌症患者等)中也有该菌感染的报道[8]。2007年发表的一份调查报告显示,在1998年—2006年FDA非无菌药品微生物污染召回事件中,占22%的污染微生物为洋葱伯克霍尔德菌,污染药品类型包括:痤疮膏、糖浆、吸入液、非酒精身体喷雾剂、婴儿油、洗发水和漱口水[9]。2004年—2011年,有34%的产品召回与该菌的污染有关[10]。2012年—2019年的FDA召回事件表明,洋葱伯克霍尔德菌是非无菌药物微生物污染召回的头号原因(占45.3%,共发生102次召回)[11]。这些召回事件引起了美国药典委员会的重视, 并特别发布USP<60>非无菌产品的微生物学检查:伯克霍尔德菌复合物,以检测非无菌产品中是否存在BCC物种。
BCC之所以是制药行业主要的不可接受微生物,主要原因是由于它具备以下能力:①能在寡营养和低渗透压的纯水环境生存的能力。保持完整外膜结构的能力与该菌在水环境中长期存活有关[12]。在营养缺乏时,形态从典型的革兰氏阴性杆菌转变为球菌,并可进入休眠状态活着但不可培养。该阶段细胞代谢活性降低,膜脂成分改变,导致外膜通透性降低,从而增加对多黏菌素B的耐受性。此外,大多数基因表达水平降低,而氨基酸、脂肪酸和磷脂代谢基因表达水平增加,这表明这些化合物可以在营养缺乏的情况下替代碳源和能源[13]。②BCC具备可以在多种药物中生长和增殖能力。BCC 细菌能够使用多种有机化合物作为碳源和能源,其中一些是很难分解代谢的外源性物质[14]。例如,它们能够通过对芳香结构氧化并对卤化化合物进行分解,从而在硝基芳香族和芳香族化合物中生存,可导致药品活性成分的降解,从而影响药物的稳定性和纯度,以及它们的效力和有效性[15]。药物降解还可能导致有毒物质的形成[16]。最终对这类产品的消费者构成了严重的风险。③对细菌抑制剂、抗生素有强大的耐受机制的能力。它们可以通过形成生物被膜、耐药基因等方式抗逆。
2.2 皮氏罗尔斯顿菌
通过分析2012年—2019年的FDA召回报告发现,罗氏菌(占总召回数的20%,共发生45次召回)排在洋葱伯克霍尔德菌之后,是非无菌药物微生物污染召回的第二大原因[11]。
罗尔斯顿菌属最初的分类学分支在假单胞菌家族,然后转到伯克霍尔德菌属, 2004年Vaneechoutte等[17]将Ralstonia spp单独列为一个属。
皮氏罗尔斯顿菌是该属的代表菌,可在水管中形成生物膜。研究也已证明它能产生高丝氨酸内酯,这是生物膜发育过程中的细胞间信号分子[18]。该菌也在发现号航天飞机水系统、火星奥德赛探测器封装设施系统中检测到[19]。
皮氏罗尔斯顿菌不被认为是主要病原体,它的毒力也较低,但它引起的感染报导屡见不鲜,包括血流感染[20]、脑膜炎[21]和疟原虫体外培养污染[22]等。许多皮氏罗尔斯顿菌感染病例是由于受污染的溶液引起的,包括注射用水、用纯化水制成的盐水溶液和无菌药物溶液。这些药物可以静脉注射和作为滴注液,用于清洁伤口或用于气管内吸痰,从而导致血液(菌血症)和呼吸道感染[23]。而这些溶液产品的污染最大可能是发生在制造阶段。过滤器往往用于一些药物的终端灭菌,但皮氏罗尔斯顿菌能够通过0.45μm和0.22μm的滤膜,从而使得终产品染菌[24]。在1983年,5名婴儿因为使用了受皮氏罗尔斯顿菌污染的呼吸治疗溶液而被感染,而这正是由于蒸馏水的生产过程中绕过了一个82℃的储槽,使得该菌活着进入了溶液[25]。此外,该菌也能在医院消毒剂中存活,包括洗必泰和乳酸依沙吖啶[26]。
尽管皮氏罗尔斯顿菌毒力很低,但正如上文所提及的该菌已被确定为会导致许多潜在的有害感染和死亡。因此,制药用水中尤其要控制此菌的污染。
3、制药用水系统的微生物控制措施
即使药企对制药用水系统进行严格的控制,还是有很小数量微生物存在于各个级别的用水系统中。此外,制药企业对于水系统的微生物检测也有不足之处,主要有:①水中的微生物分布遵循泊松分布而非均匀分布,这使得水体微生物的回收率往往重复性不佳;②培养条件的限制。培养基的选择性和培养时长的受限,都会影响水体中微生物的回收率。如受培养基的选择性,Prosthecate bacteria( 柄杆菌) , Mycobacterium species(分枝杆菌), Spirochaetes( 螺旋体) ,Thiobacillus species(硫杆菌属)等种类很难被培养;③采样方式的局限性。目前的采样大多针对自由漂浮状态的微生物,而不是对附着在底层的微生物或生物膜群落的部分进行检测;④制药用水是一个营养及其缺乏的极端环境,绝大多数的微生物以“活着但不可被培养”或者生物被膜的状态存在,因此目前药企的培养结果也仅占水系统微生物的小部分。
正是由于微生物在制药用水系统中的不确定性,制药企业的微生物专家需要考虑和了解水系统中的微生物的不断变化的模式,开展一系列的工作,包括:①建立各级水系统的微生物数据库。对构成不同水系统微生物常见分离株进行鉴定,并了解不同水质之间是否存在关系。②建立趋势分析的方法。可以连续几年对水系统中的微生物数据进行比较和趋势分析,检查微生物的种类是否与预期在水系统中发现的微生物相似,同时能够对趋势的任何变化作出及时的响应。③收集并建立水系统常见的微生物菌种库,用于培养基验证、消杀验证等。
4、结束与展望
本文综述了3个级别的制药用水中的主要微生物种类,不同级别的制药用水的微生物污染种类存在差异。从国内外研究情况来看,饮用水微生物中主要的3个属为Pseudomonas ,Brevundimonas 和Sphingomonas,纯化水微生物中主要的属为Ralstonia 和Burkholderia,注射用水微生物数量很少超过药典规定和企业内部质控要求,但在日常注射用水微生物控制时不仅要关注革兰氏阴性菌风险,同时也不能忽视环境人员污染风险。这些研究可以为各家药企对自身水系统的微生物监测提供一个参考数据。BCC 和皮氏罗尔斯顿菌是制药用水中主要的污染菌,未来对于污染菌的溯源问题,可采用全基因组测序的方式实现。此外,水系统中还有一些常见革兰氏阴性细菌如Sphingomonas paucimobilis 和Stenotrophomonas maltophilia 等也存在一定的生物安全隐患。对6株S. paucimobilis进行全基因组测序分析发现它们均含有氟喹诺酮类抗生素和四环素抗性,3个毒力因子为所有菌共含有。对鉴定结果为S. maltophilia的7株菌进行全基因组分析,发现大部分耐氟喹诺酮类、大环内脂类抗生素、利胆醇和四环素,有17个毒力因子为所有菌共有(未发表数据)。因此,为控制水系统微生物污染的风险,除了水系统的科学设计外,对于每家药企来说,应基于警戒限和行动限进行趋势分析[27],并根据各自水系统的使用情况建立微生物规范。作为一般指导,水系统应至少每年进行1次回顾,关注代表性和潜在微生物的检出情况。
参考文献
[1] WANG L J. Discussion of quality standard for pharmaceutical water and preparation in the system technology[J]. Chin J Pharm(中国医药工业杂志), 2018, 49(9): 1230-1238.
[2] 中国药典. 四部[S]. 2020: 〈0261〉制药用水.
[3] SANDLE T. Characterizing the microbiota of a pharmaceutical water system-A metadata study[J]. SOJ Microbiol Infect Dis, 2015, 3(2): 1-8.
[4] HU Y, HU D, YU X, et al. Evaluation for source water biosafety in Qiandao Lake, China[J]. Acta Sci Circumstantiae(环境科学学报), 2021, 41(2): 634-640.
[5] SHUKSHITH K S, GUPTA N V. Water for Pharmaceutical Use[J]. Int J Pharm Sci Rev Res, 2016, 36(1): 199-204.
[6] ZHANG W, BIAN C H, CHEN H, et al. Effect of microbiology ecology in main seal water system of power plants[J]. Nucl Power Eng(核动力工程), 2016, 37(S1): 64-67.
[7] ZHENG X L, WANG Y H, CAO W, et al. Establishment and analysis of microbial library in pharmaceutical water system of high-risk injection manufacturer[J]. Chin J Mod Appl Pharm(中国现代应用药学), 2021, 38(9): 1065-1068.
[8] LI M, ZHANG M, ZHONG Y W, et al. Spidemiological survey of an outbreak of nosocomial infection caused by Burkholderia cepacian[J]. Chin J Nosocomiol(中华医院感染学杂志), 2020, 30(15): 2326-2329.
[9] JIMENEZ L. Microbial diversity in pharmaceutical product recalls and environments[J]. PDA J Pharm Sci Technol, 2007,61(5): 383-399.
[10] SUTTON S, JIMENEZ L. A review of reported recalls involving microbiological control 2004-2011 with emphasis on FDA considerations of “Objectionable Organisms”[J]. Am Pharm Review, 2012, 15(1): 42-57.
[11] JIMENEZ L. Analysis of FDA enforcement reports(2012-2019) to determine the microbial diversity in contaminated non-sterile and sterile drugs[J]. Am Pharm Review, 2019, 22(6): 1-21.
[12] MOORE R A, TUANYOK A, WOODS D E. Survival of Burkholderia pseudomallei in water[J]. BMC Res Notes,2008(1): 11.
[13] LEWENZA S, ABBOUD J, POON K, et al. Pseudomonas aeruginosa displays a dormancy phenotype during long-term survival in water[J]. PLoS One, 2018, 13(9): e0198384.
[14] ZURITA J, MEJIA L, ZAPATA S, et al. Healthcare-associated respiratory tract infection and colonization in an intensive care unit caused by Burkholderia cepacia isolated in mouthwash[J].Int J Infect Dis, 2014(29): 96-99.
[15] JIMENEZ L, KULKO E, BARRON E, et al. Burkholderia cepacia: a problem that does not go away![J]. EC Microbiology, 2015, 2(1): 205-210
[16] RATAJCZAK M, KUBICKA M M, KAMIŃSKA D, et al.Microbiological quality of non-sterile pharmaceutical products[J]. Saudi Pharm J, 2015, 23(3): 303-307.
[17] VANEECHOUTTE M, KÄMPFER P, DE BAERE T, et al.Wautersia gen. nov., a novel genus accommodating the phylogenetic lineage including Ralstonia eutropha and related species, and proposal of Ralstonia[Pseudomonas] Syzygii(Roberts et al. 1990) comb. nov[J]. Int J Syst Evol Microbiol,2004, 54(Pt 2): 317-327.
[18] ADLEY C, SAIEB F. Microbials: Biofilm formation in high-purity water: Ralstonia pickettii a special case for analysis[J]. Ultrapure Water, 2005, 22(1): 14-19.
[19] MCBAIN A, ALLISON D, PLATTEN J, et al. Biofilms:Persistence and Ubiquity[M]. Cardiff: Biofilm Club, 2005.
[20] WANG X X, SONG Y Q, CAO Y D, et al. Pharmaceutical care for a patient with hemophilic lymphocytosis secondary to ralstonia bloodstream infection during pregnancy[J]. Central South Pharm(中南药学), 2021, 19(1): 130-133.
[21] WANG P L, WU Z P. Metagenomic next-generation sequencing for the diagnosis of Ralstonia pickettii meningitis:A case report and literature review[J]. J New Med(新医学),2020, 51(6): 478-481.
[22] YIN Y, LU F, XU J H, et al. Detection of blood contamination caused by Ralstonia pickettii during in vitro culture of Plasmodium falciparum[J]. J Pathog Biol(中国病原生物学杂志), 2018, 13(12): 1324-1326, 1334.
[23] RYAN M P, PEMBROKE J T, ADLEY C C. Ralstonia pickettii: A persistent gram-negative nosocomial infectious organism[J]. J Hosp Infect, 2006, 62(3): 278-284.
[24] ANDERSON R L, BLAND L A, FAVERO M S, et al. Factors associated with Pseudomonas pickettii intrinsic contamination of commercial respiratory therapy solutions marketed as sterile[J]. Appl Environ Microbiol, 1985, 50(6): 1343-1348.
[25] MCNEIL M M, SOLOMON S L, ANDERSON R L, et al.Nosocomial Pseudomonas pickettii colonization associated with a contaminated respiratory therapy solution in a special care nursery[J]. J Clin Microbiol, 1985, 22(6): 903-907.
[26] OIE S, KAMIYA A. Bacterial contamination of commercially available ethacridine lactate (acrinol) products[J]. J Hosp Infect, 1996, 34(1): 51-58.
[27] WANG S J, YU M, WANG G G, et al. Environment monitoring and environmental microbial library establishment in clean area of pharmaceutical industries[J]. Chin J Pharm(中国医药工业杂志), 2020, 51(10): 1334-1340.
本文作者李樱红、张林爽、李珏、郑小玲、王征南、王银环、陈君豪、洪亮、陶巧凤、陈欢,浙江省食
品药品检验研究院、NMPA微生物检测与预警重点实验室、浙江省药品接触材料质量控制研究重点实验室、台州市药品检验研究院、杭州微数生物科技有限公司,仅供交流学习。