内源性药物简介:源性物质是机体内天然存在的物质,是代谢中产生的活性物质及最终产物,包括维生素、激素、蛋白质及电解质类等[1]。这类药物药理作用强,副作用小,很少引起过敏反应,因此从研究内源性物质着手寻求治疗疾病的药物成为新药研发的最重要的途径之一,大量内源性药物应运而生。
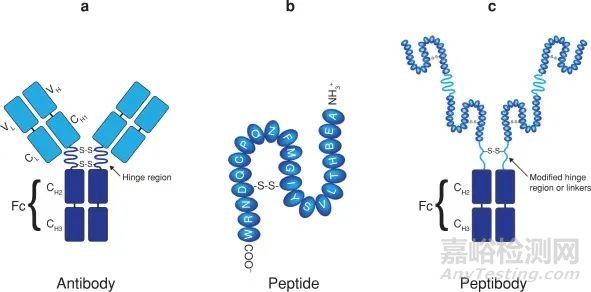
由于内源性药物是体内为维持生命所产生的生物物质,具有代谢反应半衰期较短、稳定性差缺点,对pH值、金属离子、温度等环境因素较为敏感。为增强药物的稳定性和半衰期,小分子药物一般使用化学修饰的方式;大分子药物则采用化学修饰和与大蛋白融合等方式。最常见的技术是Fc融合蛋白、血清白蛋白融合蛋白和转铁蛋白融合蛋白[2] [3]。其中,Fc融合蛋白是指通过基因工程技术将功能蛋白与抗体的Fc片段融合而成(图1)。这种融合策略不仅保留了功能蛋白的生物活性,而且延长了半衰期,提高了稳定性,有利于融合蛋白的表达、纯化和检测[4]。
图1. FC 融合蛋白结构[4]
已上市的内源性药物:目前比较热门的重组蛋白中的功能片段有如下几类[5]:
1.多肽类激素如:胰岛素及胰岛素类似物、生长激素、促卵泡成熟激素等;
2.细胞因子主要有: 白细胞介素(Interleukin,IL)、干扰素(interferon,IFN)、肿瘤坏死因子(tumor necrosis factor,TNF)、集落刺激因子(colony stimulating factor,CSF)、生长因子(growth factor,GF)、趋化性细胞因子(chemokine);
3.酶如:尿激酶原。
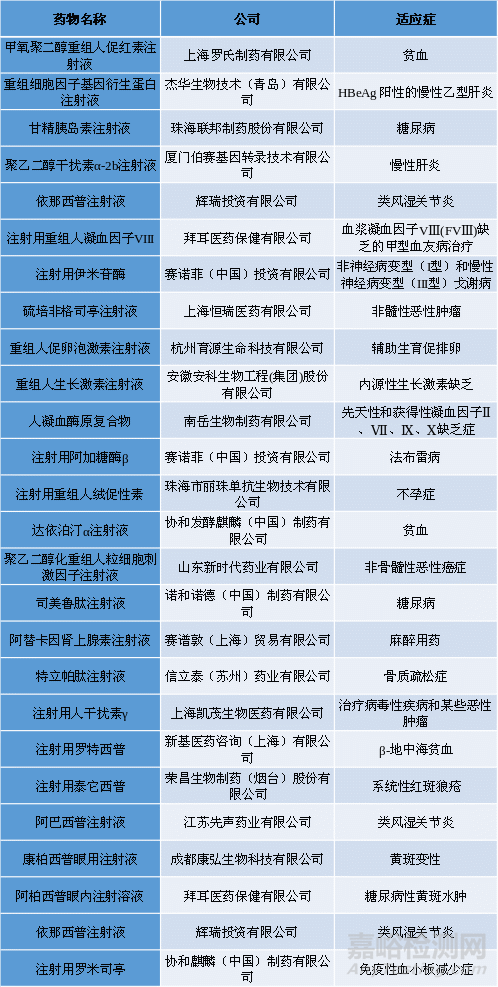
表一总结了目前已上市的内源性药物[6]。
表1.已上市的内源性药物[6]
内源性药物生物分析难点:内源性药物的生物分析主要包括PK药代动力学、ADA抗药抗体以及Nab中和抗体分析。分析所用到的方法主要包括LC-MS/MS和LBA配体受体结合试验。在内源性药物的分析方法建立中,正是由于内源性药物区别于外源性药物的特征,造成了其生物分析的挑战和难点,主要表现在以下几方面:
1.如何消除内源物对检测的干扰
在传统生物分析过程中,用于制备校准标准品的基质应尽可能与含有分析物的研究样品相似。然而,在定量生物样品中的内源性物质时,空白基质还包含影响分析水平的分析物。同时,由于多肽的内源性对应物在体内是动态变化的,因此如何消除内源性对检测的干扰是需要考虑的。
2.空白基质的获取
由于内源性药物是机体内天然存在的物质,人的实际基质中也含有内源性物质,因此,在检测过程中,如何排除干扰取得真正不含待测物的生物基质制备标准曲线是进行PK药代动力学的重要挑战。
3.稳定性的影响
由于机体自身稳定性机制,内源性药物的稳定性问题是在生物分析方法开发中常见的问题,尤其是一些缺乏修饰基团或多肽两端缺乏保护性基团的多肽类分子。对pH值、金属离子、温度等环境因素较为敏感,甚至降解或产生构象变化为生物分析方法的稳定性研究带来挑战。
4.多结构域治疗性的免疫原性分析较为复杂
对于大分子药物,为增强内源性药物的稳定性和半衰期,通常将内源性分子与大蛋白融合。融合引入新的抗原表位,对确证为阳性的样本免疫原性分析需要开展结构域特异性评价。
2、内源性药物指导原则比较和解读
PK药代动力学指导原则
2018年FDA Guidance (Bioanalytical Method Validation Guidance for Industry)第5节第1部分描述了内源性物质的生物分析[7]。指导原则指出“对于内源性分析物,当分析不能区分治疗剂和内源性对应物时,分析物测量的准确性提出了挑战。在这种情况下,建议采用以下方法来验证和监测分析性能。如果有科学原理的支持,也可以考虑其他方法。1)用于制备校准标准品的生物基质应与研究样品相同,且不含内源性分析物。应证明基质具有:a)无可测量的内源性分析物或b)与生物基质相比,无基质效应或干扰。使用替代基质(如缓冲液、透析血清)制备校准标准品也是合理的。QC样品的制备方法是在与研究样品相同的生物基质中加入已知数量的分析物。应在QC制备前评估生物基质中分析物的内源性浓度(例如,通过重复分析)。QC的浓度应考虑生物基质(即添加剂)中的内源性浓度。2)内源化合物的生物分析应评估其平行性。”
虽然FDA明确建议了关于内源性药物方法验证的建议,但却未对准确度与精密度如何计算、选择性以及平行性如何评估等具体的细节做出相关决定。2022年5月24日新生效的ICHM10(Bioanalytical method validation and study sample analysis)第7.1部分着重强调了待测物同为内源性物质的分析方法[8],包括7.1.1质控样品,7.1.2选择性、回收率与基质效应,7.1.3平行性,7.1.4准确度与精密度以及7.1.5稳定性的分析方法。下面将对相关章节进行详细的解读。
研究样品中待测物浓度计算方法:ICH M10中提供了4种计算研究样品中待测物浓度方法(图2):替代基质法、替代待测物法、背景扣除法和标准添加法。
1、替代基质法是使用简单缓冲液或人工基质等,代替存在干扰的基质来配制标准曲线。该方法经济实用,获取方式相对简单,是配体结合实验中较为常用的方法。
2、替代待测物法是采用稳定同位素标记的待测物作为替代分析物,常用于色谱法中。该方法的优势在于可以采用与生物样本相同的真实基质。
3、背景扣除法同样也可以采用真实基质,该方法是在真实基质中添加待测物,用测得的浓度减去在基质中测得的内源性物质浓度,使用净差值来建立标准曲线。
4、标准添加法仅适用于具有线性响应的分析平台。
图2.四种计算研究样品中待测物浓度方法[8]
质控样品的配制:在制备QC样品之前,应评估生物基质中内源性物质浓度。对于QC样品的配制,通常LQC和LLOQ会使用未添加待测物的基质,ULOQ、HQC和MQC则是通过向基质(LQC或LLOQ)中添加已知浓度的待测物来制备。添加样品(LQC或LLOQ)中待测物添加量应足以提供比内源性物质浓度高三倍以上,或统计学上足以显示比内源性浓度更高。若基质中的内源性水平较高,无法用于制备LQC,则考虑使用稀释基质或替代基质。
选择性、回收率与基质效应评估:对于选择性、回收率与基质效应评估,ICH M10详细描述了替代基质、替代待测物、实际生物基质的选择性如何评估。1)如果方法使用了替代基质法,应评估替代基质和实际基质中不同基质效应和回收率的影响。应在同一项实验中,采用基质中加入待测物、仅内源性基质以及替代基质中加入待测物得到的QC样品,用替代校准曲线进行分析。2)如果在质谱色谱法中使用替代待测物方法,应评估替代待测物和实际内源性物质之间不同基质效应和回收率的影响。应在同一项实验中,采用基质中加入待测物、仅内源性基质以及替代物加入基质中得到的QC样品,用替代基质校准曲线进行分析。3)在某些情况下,当内源性物质水平较高且LLOQ需要降低时,可能需要使用替代基质稀释QC样品(例如背景扣除法)。此时,应使用内源性物质浓度在LLOQ和LQC之间的实际生物基质(如果可用),重复进行回收率和基质效应实验。4)由于生物基质的成分可能会影响方法性能,因此要对至少6种(色谱法)/10种(LBA法)的实际生物基质的选择性进行评估。
平行性:对于平行性评估,应在替代基质和替代待测物方法中对平行性进行评估,并考虑LBA法和色谱法中对平行性的评估不同。
准确度和精密度:如果使用替代基质或替代待测物方法,应根据替代校准曲线分析QC样品来评估准确度和精密度。比较重要的一点是,ICH M10明确指出了内源性药物的准确度的计算公式。当QC样品由含有内源性水平的待测物的基质中加入真实待测物制备时,建议使用以下公式计算准确度:
稳定性:为了尽可能模拟研究样品,应对2.1.2章节描述的HQC和LQC的稳定性进行评估。如果替代基质用于配制标准曲线,还应评估替代基质中待测物的稳定性。
ADA抗药抗体指导原则
对于ADA抗药抗体的检测,2019年美国FDA发表的“Immunogenicity Testing of Therapeutic Protein Products —Developing and Validating Assays for Anti-Drug Antibody Detection”[9]和2021年国家药品监督管理局发布的《药物免疫原性研究技术指导原则》[10]均明确指出“对于多结构域治疗性蛋白药物,如聚乙二醇化蛋白、多特异性抗体,建议针对整个治疗性蛋白药物进行初步筛选试验和确证试验,基于风险或产品特征,对确证为阳性的样本进一步开展域特异性评价。”
Nab 中和抗体分析指导原则
对于Nab中和抗体的检测,其指导原则与常规的大分子的指导原则类似,有基于细胞的中和抗体检测方法和非基于细胞的中和抗体检测方法,可以根据具体的大分子药物的作用机制、选择性、灵敏度、精度和稳健性等选择分析方法。一般来说,FDA建议使用基于细胞的生物测定法进行中和试验[10]。
参考文献:
[1] Zhu Q, Huang Z, Huang Y, Qin Y. [Expression of rhEPO-L-Fc fusion protein and analysis of its bioactivity and pharmacokinetics]. Sheng Wu Gong Cheng Xue Bao. 2008 Nov;24(11):1874-9. Chinese.
[2] Kontermann RE. Half-life extended biotherapeutics. Expert Opin Biol Ther. 2016 Jul;16(7):903-15. doi: 10.1517/14712598.2016.1165661. Epub 2016 Apr 18. Erratum in: Expert Opin Biol Ther. 2016 Sep;16(9):1179.
[3] Steiner D, Merz FW, Sonderegger I, Gulotti-Georgieva M, Villemagne D, Phillips DJ, Forrer P, Stumpp MT, Zitt C, Binz HK. Half-life extension using serum albumin-binding DARPin® domains. Protein Eng Des Sel. 2017 Sep 1;30(9):583-591.
[4] Pei D, Hu J, Rao C, Yu P, Xu H, Wang J. Anti-Tumor Activity and Pharmacokinetics of AP25-Fc Fusion Protein. Int J Med Sci. 2019 Jun 10;16(7):1032-1041.
[5] An G, Ohls RK, Christensen RD, Widness JA, Mock DM, Veng-Pedersen P. Population Pharmacokinetics of Darbepoetin in Infants Following Single Intravenous and Subcutaneous Dosing. J Pharm Sci. 2017 Jun;106(6):1644-1649.
[6]来源:国家药品监督管理局药品审评中心。部分同类或BE药物不予展示。
[7]US FDA Guidance for Industry, Bioanalytical Method Validation, May 2018.
[8] ICHM10 Guideline, Bioanalytical method validation and study sample analysis, 24 May 2022.
[9] US FDA Guidance for Industry, Immunogenicity Testing of Therapeutic Protein Products —Developing and Validating Assays for Anti-Drug Antibody Detection, 24 May 2022.
[10]国家药品监督管理局,药物免疫原性研究技术指导原则, 2021.