今日头条
康威肿瘤免疫新药获批实体瘤临床。康威生物肿瘤免疫新机制创新药CAN2109获FDA批准开展Ⅰ期试验,拟用于治疗多种实体瘤。这是该公司继CAN1012之后获得FDA批准开展临床试验的第二款创新药。CAN1012是一种TLR7小分子激动剂,它能够将“冷”肿瘤转变为有免疫应答的“热”肿瘤,使自身的免疫系统得以识别和攻击肿瘤细胞。目前,康威生物正在中美两地同步CAN1012的临床开发。
国内药讯
1.亚盛Bcr-Abl抑制剂获批新适应症。亚盛医药第三代BCR-ABL抑制剂奥雷巴替尼片(耐立克)获国家药监局批准新适应症,用于治疗一代和二代酪氨酸激酶抑制剂(TKIs)耐药/不耐受的慢性髓细胞白血病(CML)慢性期(CP)患者。在Ⅰ期研究中,奥雷巴替尼在CML-CP患者中达到100%的完全血液学缓解率,70%的完全细胞遗传学缓解率。2021年7月,信达生物已获得HQP1351在大中华区联合开发及商业化的授权。
2.维昇引进促骨生长新药II期临床成功。维昇药业与Ascendis Pharma开发的长效C型-利钠肽(CNP)TransCon CNP治疗2-10岁软骨发育不全(ACH)儿童患者的中国II期临床达到主要终点。与安慰剂相比,每周接受100μg CNP/kg治疗52周后,患者的年化生长速率显著提高(5.939vs4.760cm/年,P=0.018)。该项试验结果与全球II期ACcomplisH研究结果一致。
3.宜明昂科VEGF/PD-L1双抗启动II期临床。宜明昂科PD-L1/VEGF双抗IMM2510在治疗晚期复发难治性软组织肉瘤的II期临床完成首例患者给药。在I期临床爬坡研究中,IMM2510已在肺腺癌、肺鳞癌以及胸腺癌中显示出初步疗效,使患者肿瘤明显缩小(PR),而且PR超过9个月。目前IMM2510已获批联合化疗针对不同适应症的II期IND,以及IMM2510联合IMM27M针对不同适应症的Ib/II期IND。
4.复星三靶点溶瘤腺病毒获批临床。复星医药1类生物制品VT-101注射液获国家药监局临床许可,拟用于治疗晚期头颈部鳞癌、黑色素瘤和乳腺癌等实体瘤。VT-101是一款具有三重肿瘤靶向调控机制、三个病毒结构基因改造、三种血清型腺病毒嵌合、三类抗癌免疫基因装载的重组溶瘤腺病毒产品。该产品通过注射入肿瘤病灶内,使其在肿瘤细胞内自我复制,以裂解肿瘤细胞。
5.祐森健恒KRAS G12D抑制剂授权AZ。祐森健恒与阿斯利康就临床前期小分子KRAS G12D抑制剂UA022达成授权协议,阿斯利康将获得UA022在全球独家开发和商业化权益。根据协议,祐森健恒将获得2400万美元的首付款,最高达3.95亿美元的开发和商业化里程碑潜在付款,以及产品的销售分成。在临床前模型中,UA022已显示出强大的抗癌活性,并具有良好的安全性。目前,全球尚无KRASG12D抑制剂获批上市。
国际药讯
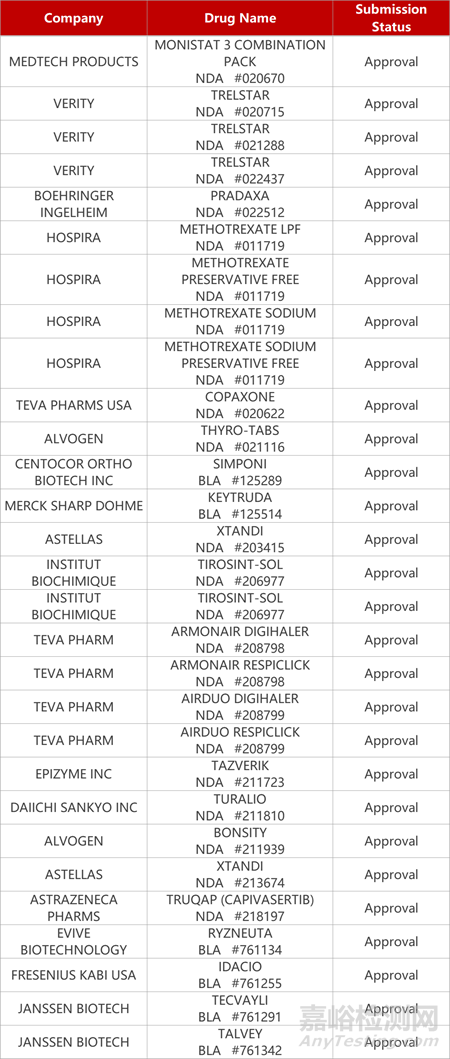
1.阿斯利康AKT抑制剂获批上市。阿斯利康AKT抑制剂Truqap(capivasertib)获FDA批准上市,联合fulvestrant用于治疗HR+/HER2-、晚期或转移性乳腺癌成年患者。在III期研究中,capivasertib联合治疗较安慰剂提高PIK3CA/AKT1/PTEN变异肿瘤患者的无进展生存期(中位PFS:7.3个月vs3.1个月),将患者疾病进展或死亡风险降低50%。今年10月,CDE也受理该新药在中国递交的上市申请。
2.创新治疗蛋白疗法报滚动BLA。Polaris Group公司旨在破坏癌细胞代谢的蛋白疗法pegargiminase(ADIPEG 20)已向FDA滚动递交生物制品许可申请(BLA),与铂类药物和培美曲塞联用治疗恶性胸膜间皮瘤(MPM)患者。Pegargiminase通过将血浆来源的精氨酸(arginine)转化为瓜氨酸(citrulline)来剥夺癌细胞中的精氨酸。Pegargiminase目前正在三项Ⅲ期临床中评估用于其他难治性癌症的治疗效果。
3.艾伯维CGRPR拮抗剂Ⅲ期研究见刊《柳叶刀》。艾伯维口服CGRPR抑制剂Ubrelvy(ubrogepant)用于偏头痛发作前驱期急性治疗的Ⅲ期临床PRODROME积极结果发表于《柳叶刀》上。与安慰剂相比,Ubrelvy治疗24小时内有更多患者不出现中重度头痛症状(46%vs29%,P<0.0001);没有出现任何程度的头痛症状的患者比例显著更高(24%vs14%,P<0.0001);Ubrelvy总体耐受性良好。2019年,Ubrelvy已在美国获批上市,是FDA批准的首款口服CGRPR拮抗剂。
4.MEK抑制剂NF1-PN的Ⅱb期临床积极。SpringWorks公司MEK抑制剂mirdametinib治疗神经纤维瘤病1型相关的丛状神经纤维瘤(NF1-PN)患者的Ⅱb期临床结果积极。经盲态独立中心评估,mirdametinib在儿童和成人患者中获得确认的客观缓解率分别为52%和41%;靶肿瘤体积分别缩小42%和41%。此外,药物安全性良好。该公司计划在2024年向FDA递交新药申请(NDA)。
5.雷帕霉素凝胶获突破性疗法认定。Palvella公司新型、3.9%雷帕霉素无水凝胶Qtorin获FDA授予突破性疗法认定,用于治疗微囊性淋巴管畸形(Microcystic LMs)。在Ⅱ期试验中,与基线相比,Qtorin雷帕霉素治疗显著改善患者包括病变高度、渗漏和出血等多项重要疾病负担,受试者达到临床医生疗效总评量表“大幅度改善”或“极大幅度改善”的比例为100%。Palvella计划尽快开展关键Ⅲ期临床。
6.默沙东P2X3受体拮抗剂上市遭拒。默沙东P2X3受体拮抗剂Gefapixant未能获得FDA肺部及过敏相关药物审查委员会推荐批准上市,用于治疗难治性慢性咳嗽。在两项Ⅲ期临床中(P030和P027),Gefapixant(45mg)治疗相比于安慰剂24小时咳嗽频率分别下降14.6%和17%。2022年1月,日本厚生劳动省已批准Gefapixant上市,是全球首个获批的P2X3受体拮抗剂。
医药热点
1.牟姗任上海交通大学医学院副院长。近日,上海公布一批人事任免,其中包括任命牟姗为上海交通大学医学院副院长。根据公开信息,牟姗,女,1972年出生,中共党员,汉族,黑龙江哈尔滨人,研究生学历,医学博士,教授、主任医师,博士生导师。历任附属仁济医院人力资源处处长,上海交通大学医学院人事处处长、党委教师工作部部长,附属仁济医院党委副书记、副院长、工会主席。
2.上海将进一步做好家庭病床服务工作。近日,上海市发布《关于进一步做好本市家庭病床服务工作的通知》,旨在持续扩大家庭病床服务覆盖,重点加强对老年人的家庭病床服务,强化家庭病床服务覆盖社区卫生服务中心对接的养老机构。丰富服务内涵,增加服务供给,确保居民获得高质量的家庭病床服务。《通知》指出,结合家庭病床服务中的服务项目,家庭医生可开具医嘱,为护理站服务提供支撑,促进长护险服务与家庭病床服务有效衔接、相互补充,提高家庭病床服务效能。
3.北京积水潭医院心理行为医学科开诊。为了更好地满足广大群众的心理健康就医需求,有效应对心理压力,提高心理素质,预防心理疾病的发生,北京积水潭医院心理行为医学科于11月20日在回龙观院区正式开诊。心理行为医学科门诊提供多种心理治疗方式,包括心理咨询、心理治疗、心理康复等,涵盖了抑郁症、焦虑症、强迫症、失眠症等多种常见心理疾病。医生可根据患者的具体病情和需求,量身定制最佳治疗方案。
评审动态
1. CDE新药受理情况(11月20日)
2. FDA新药获批情况(北美11月17日)