残留的肿瘤细胞和骨组织缺损是临床骨肉瘤治疗的两个关键挑战。近日,上海大学陈雨教授、冯炜副研究员和山东大学齐鲁医院刘培来教授通过将MoO3−x亚纳米线集成到3D打印生物活性玻璃支架上构建自适应功能组织工程支架,从而提出亚纳米医学概念。MoO3−x亚纳米线是通过一锅水热法合成的,该方法在酸性肿瘤微环境中聚集,并与过氧化氢反应产生活性氧,用于特定的化学动力学治疗。而且它们可以在生理条件下快速降解而不引起毒性。此外,自适应增强的光热转换使肿瘤靶向光热治疗,同时增强化学动力学治疗。通过免疫印迹分析、共聚焦激光扫描显微镜观察和mRNA转录组分析,Mo5+-Mo6+转变使脂质过氧化物积累和谷胱甘肽耗尽,从而导致谷胱甘肽过氧化物酶4蛋白失活和铁死亡。所构建的支架除了具有抗骨肉瘤的稳健性外,还能刺激大鼠骨间充质干细胞的分化和增殖,促进骨缺损的成骨。因此,这种多功能支架不仅验证了亚纳米医学的概念,而且为骨组织工程提供了一个很有前途的临床策略。
相关研究内容以“Self-Adaptive MoO3−x Subnanometric Wires Incorporated Scaffolds for Osteosarcoma Therapy and Bone Regeneration”为题于2023年9月8日发表在《Advanced Functional Materials》。
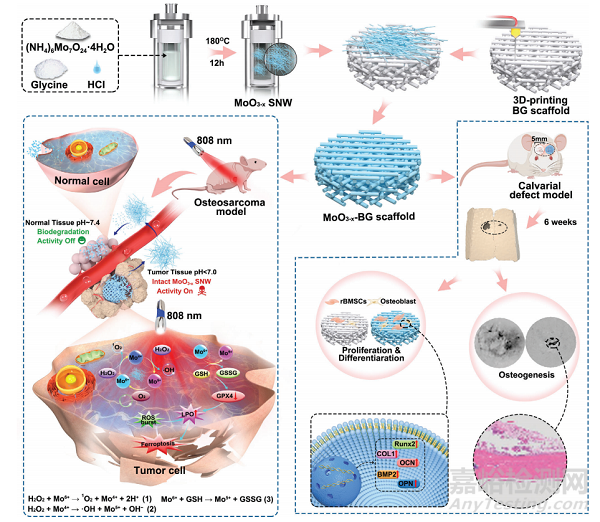
图1 MoO3−x-BG支架和相应的PTT增强CDT联合抗骨肉瘤并促进成骨的构建过程示意图
亚纳米线(SNWs)是一类新兴的具有机械灵活性的一维(1D)亚纳米材料(SNMs),具有高度高效的能量转换和优异的催化活性。在此,本研究报道了一个自适应功能治疗平台,该平台将合理设计的MoO3−xPOM亚纳米线(MoO3−xSNWs)集成到3D打印生物活性玻璃(BG)支架上,表示为MoO3−x-BG支架,用于骨肉瘤(OS)治疗和成骨(图1)。
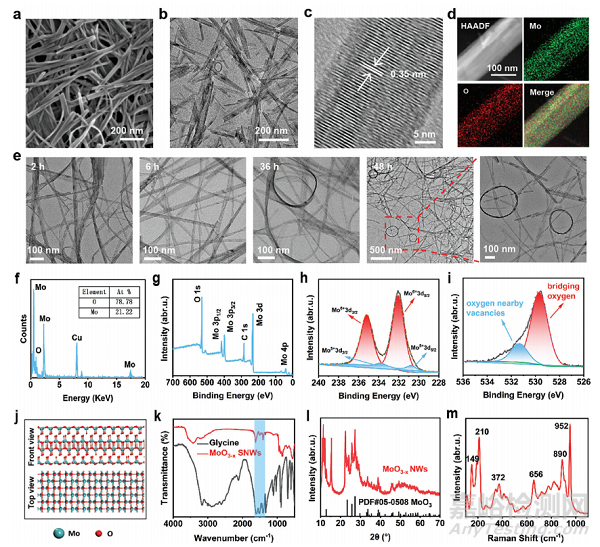
图2 MoO3−xSNWs的表征
扫描电子显微镜(SEM)和透射电子显微镜(TEM)图像显示,MoO3−xSNWs为典型的线状结构(图2a、b)。线状结构的高分辨率透射电子显微镜(HRTEM)图像显示晶格间距为0.35nm(图2c)。对MoO3−xSNWs的高角环形暗场图像、特征元素映射和相应的能量色散X射线光谱分析显示,Mo和O的比例分布良好(图2d、f)。TEM观察发现较长的搅拌时间导致卷绕结构(图2e)。X射线光电子光谱(XPS)显示其表面的化学成分和状态,其中Mo、O和C在全测量扫描中显示(图2g)。Mo 3d的高分辨率XPS谱显示,235.18和232 eV的结合能与Mo6+的存在有关,而233.8和230.8 eV的结合能与Mo5+的存在有关(图2h)。在O 1s光谱中,在531.36 eV处的峰值归因于氧缺陷(图2i)。MoO3−xSNWs的独特结构与氧缺陷的不对称分布密切相关(图2j)。傅里叶变换红外光谱鉴定了MoO3−xSNWs的结构(图2k)。MoO3−xSNWs的典型衍射峰被很好地索引到标准的α-MoO3六边形PDF卡(图2l)。MoO3−xSNWs的拉曼光谱如图2m所示。
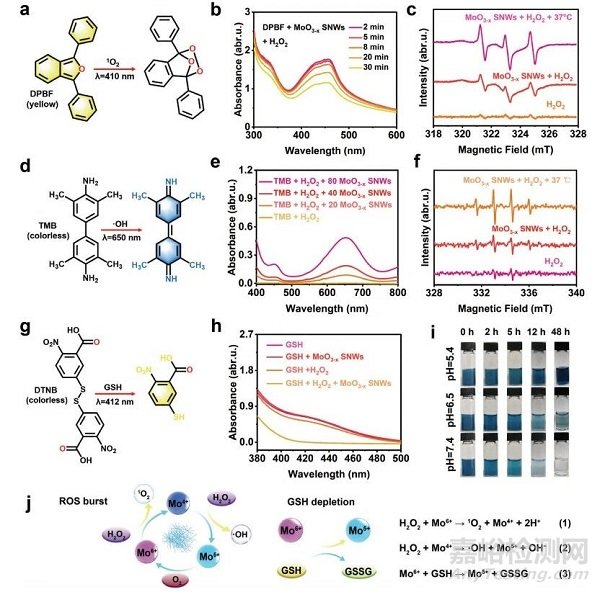
图3 MoO3−xSNWs的化学动力学性能
1,3-二苯异苯并呋喃(DPBF)是一种黄色的1O2指示剂,与1O2反应后褪色(图3a)。DPBF与H2O2和MoO3−xSNWs孵育30 min后,455 nm处的特征吸收峰下降(图3b)。电子自旋共振(ESR)光谱证实1O2的产生(图3c),其中2,2,6,6-四甲基哌啶(a 1O2捕获剂)与H2O2和MoO3−xSNWs反应,显示一个1:1:1的特征信号峰。当温度升高到37℃后,信号逐渐增强,表明1O2的产率随温度的升高而增加。以3,3′,5,5′·-四甲基联苯胺(TMB)作为·OH指标,评价·OH的产量(图3d)。随着浓度的增加,在650 nm处的特征吸光度峰的强度显著增加(图3e)。使用5,5-二甲基-1-吡咯烷n-氧化物作为自旋陷阱,通过ESR定性地确认了·OH的产生(图3f)。与其他基团相比,(GSH +H2O2+MoO3−xSNWs)组在412 nm处的吸收峰明显较低(图3h),说明MoO3−xSNWs介导的催化反应可以耗尽GSH。因此可以合理地推断,MoO3−xSNWs中的Mo5+与H2O2反应产生·OH和1O2,而产生的Mo6+消耗GSH产生氧化谷胱甘肽(图3j)。为了评估其稳定性和生物降解性,将MoO3−xSNWs分散在不同pH值的磷酸盐缓冲溶液中(图3i)。
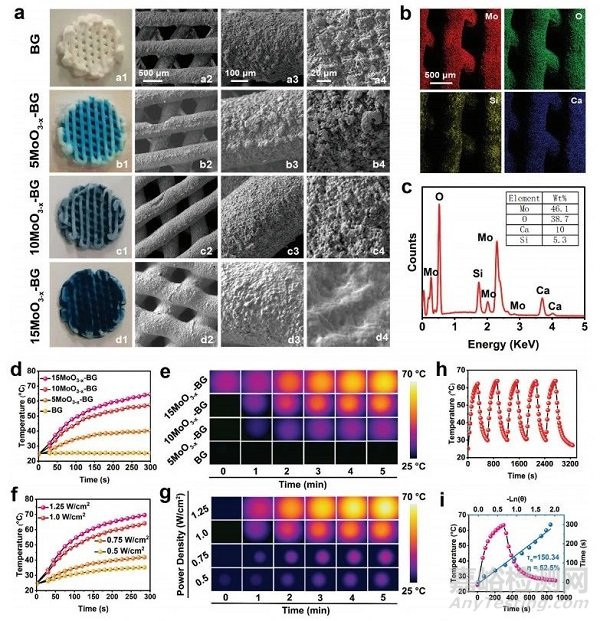
图4 MoO3−x-BG支架的组成特性和光热性能
获得的支架表现出设计良好、均匀交错的微观结构,随着MoO3−xSNWs浓度的增加,蓝色逐渐变暗(图4a1-d1)。SEM图像显示,BG支架表现出良好的大孔和粗糙的表面(图4b2-d2),MoO3−xSNWs修饰赋予BG支架光滑的表面(图4b2、d4)。相应的元素映射图像证实Mo、O、Si和Ca的分布均匀(图4b),表明支架与MoO3−xSNWs的成功整合。在808 nm激光照射下,温度随时间显著增加,且呈剂量和功率密度依赖性(图4d-g)。纯BG的温度变化可以忽略不计(图4d),说明MoO3−xSNWs的存在可以有效地、快速地将NIR光转化为热能。MoO3−x-BG支架的光热性能在5次激光开/关照射周期后的衰退可以忽略不计(图4h),从而确定光热学稳定性。MoO3−x-BG支架的光热转换效率为52.5%(图4i),表明它们具有用于后续光热癌消融的潜力。
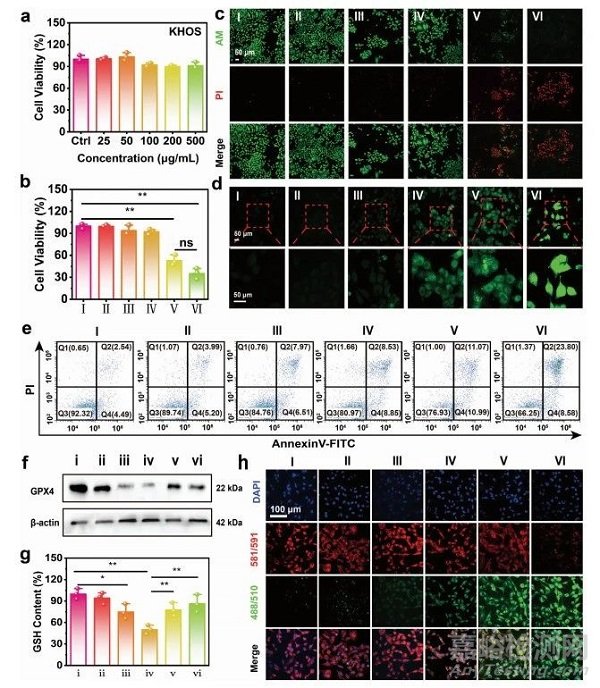
图5 在体外,通过MoO3−xSNWs进行PTT增强的血流动力学治疗(CDT)
在人成骨肉瘤(KHOS)细胞和人脐静脉内皮细胞研究MoO3−xSNWs的细胞相容性(图5a),即使在500gmL−1的高浓度下处理24 h后,其细胞毒性可以忽略不计。随后使用MoO3−xSNWs研究了体内PTT增强的CDT(图5b),结果表明PTT可以促进CDT的杀伤作用。使用钙绿素乙酰甲酯(绿色)和碘化丙啶(PI 红色)染色活/死亡细胞,确定MoO3−xSNWs介导和PTT增强的CDT的显著治疗效果(图5c)。MoO3−xSNWs+H2O2处理后的细胞凋亡率为22.1%,在激光照射下进一步上升至32.4%(图5e),表明加热可促进治疗效果。为了研究其杀伤机制,采用2,7-二氯荧光素二乙酸酯(DCFH-DA,绿色)试验,通过共聚焦激光扫描显微镜(CLSM)来验证细胞内ROS的生成(图5d)。根据蛋白印迹分析(图5f),MoO3−xSNWs+H2O2组的GPX4表达量明显低于H2O2和MoO3−xSNWs+H2O2组,而MoO3−xSNWs+H2O2组的表达水平远低于H2O2组。KHOS细胞在对照组、NIR和MoO3−xSNWs组中表现出强烈的红色和弱绿色荧光(图5h),从而表明脂质过氧化作用(LPO)的生成最少。
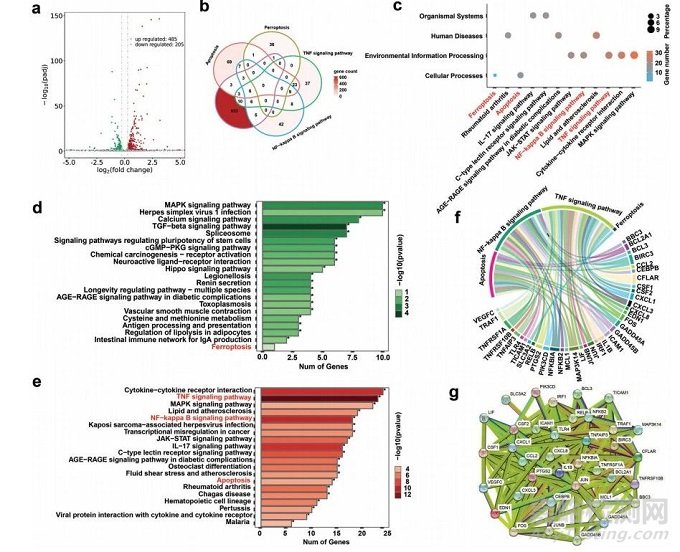
图6 MoO3−xSNWs介导协同治疗后的KHOS细胞转录组分析
根据火山图和热图(图6),协同治疗组较对照组共鉴定出约690个差异表达基因(DEGs),其中485个上调基因,205个下调基因,主要与炎症调节和应激反应有关。如维恩图所示,690个DEGs涉及铁死亡、凋亡、肿瘤坏死因子信号通路和核因子-kappaB信号通路(图6b),证实MoO3−xSNWs治疗可缓解氧化应激诱导的细胞凋亡、铁死亡和炎症。筛选690个DEGs进行KEGG分析,结果显示在MoO3−xSNWs介导的协同治疗中,这四种信号通路与铁死亡、凋亡和炎症显著相关。这37个相关功能基因的和弦图表明,MoO3−xSNWs在OS治疗过程中发挥铁死亡和炎症调节因子的作用(图6f)。通过蛋白-蛋白相互作用网络分析从4个通路中基因与DEGs的交叉点中获得的37个相关功能基因(图6g),发现与主要蛋白相连的邻近蛋白涉及PTGS2、CXCL1家族和MAP3K14,这是铁死亡和炎症的关键调控蛋白。综上结果表明,MoO3−xSNWs+H2O2+ NIR治疗可以调控与铁死亡、细胞凋亡和炎症调控相关的基因表达模式。
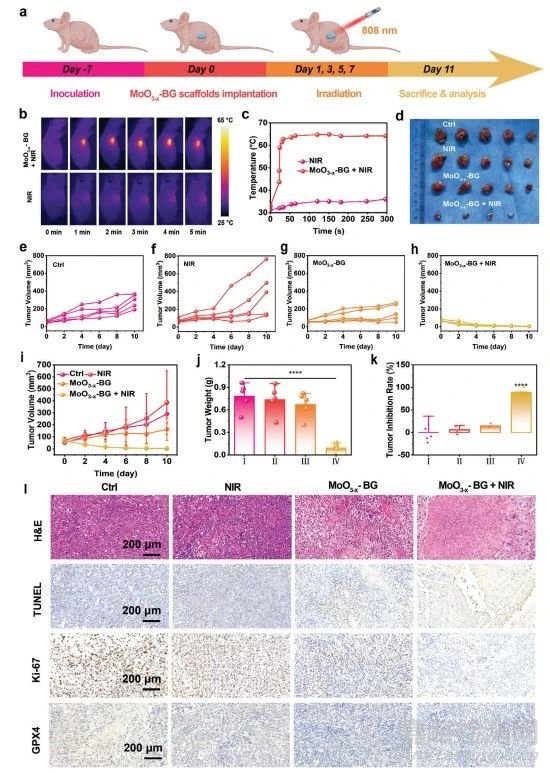
图7 MoO3−x-BG支架的CDT抗肿瘤作用
由于其具有良好的体外抗肿瘤效果,接下来研究其对OS的体内治疗性能(图7a)。MoO3−x-BG支架+ NIR激光组在5 min内的肿瘤温度从33.2°C迅速增加到64.9°C,而NIR激光组的温度变化可以忽略不计(图7b、c)。MoO3−x-BG+NIR组以100%的抑制率完全消除肿瘤(图7d-k)。为了进一步验证抗肿瘤疗效,收集所有组的肿瘤切片进行病理评估(图7l)。分别采用H&E染色、TUNEL和Ki-67抗体染色方法评估肿瘤组织的坏死/凋亡和细胞增殖活性。H&E染色结果显示MoO3−x-BG+NIR激光组有大量OS细胞坏死。TUNEL图像显示,MoO3−x-BG+NIR激光组的凋亡细胞多于其他各组,从而验证其有效性。Ki-67染色图像显示,MoO3−x-BG+NIR激光组在四组中OS细胞增殖最少,表明癌细胞的增殖受到显著抑制。GPX4的免疫组化分析显示,MoO3−x-BG+NIR激光组中GPX4的表达下调。
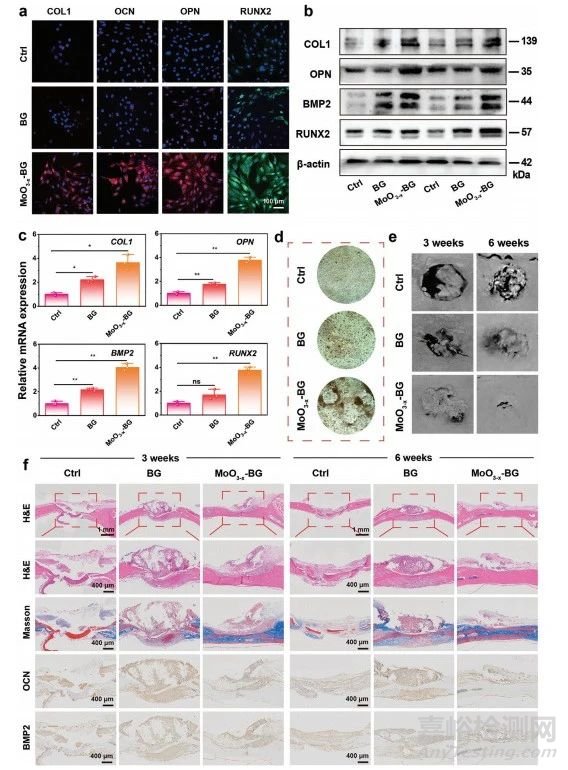
图8 成骨生物活性的体内外成骨生物活性评价
CLSM图像显示不同处理后的成骨蛋白,即1型胶原蛋白(COL1)、骨钙素(OCN)、骨桥蛋白(OPN)和runt相关转录因子2(RUNX2)的表达(图8a)。MoO3−x-BG组的荧光强度明显强于Ctrl组和BG组,从而验证MoO3−x-BG支架可以促进rBMSC的增殖。MoO3−x-BG支架组中成骨蛋白COL 1、OPN、RUNX2和骨形态发生蛋白2(BMP2)的表达水平均显著高于其他各组(图8b),从而进一步证实MoO3−x-BG支架的成骨特性。与其他组不同,MoO3−x-BG支架组促进成骨相关基因的表达(图8c),证明MoO3−x-BG支架具有理想的成骨分化能力。在孵育21天后,MoO3−x-BG支架组比Ctrl和BG组含有更多的钙结节(图8d)。采集的颅骨显微计算机断层扫描(micro-CT)重建图像直接证实缺损区域的新骨形成(图8e),MoO3−x-BG支架组在第3周从边缘扩展至颅骨缺损区中心,到第6周时几乎看不见空洞。接下来进行组织学和免疫组化染色,以进一步评估颅骨修复的疗效(图8f),结果提示MoO3−x-BG支架促进骨组织形成,胶原纤维生成及成骨基因表达。
本研究通过设计具有强大物理化学性质和独特生物效应的多功能亚纳米生物材料,将亚纳米医学的概念引入到生物材料的设计和工程中。本研究构建一个基于3D打印MoO3−x-BG支架的自适应多功能工程平台,用于OS治疗和成骨。作为一种基于Mo的POMs,MoO3−xSNWs不仅具有优异的光热转换效率,而且具有pH和氧化还原响应性。肿瘤内MoO3−xSNWs和还原剂GSH之间的氧化还原反应导致GSH的消耗。同时,Mo6+还原为Mo4+,随后Mo4+氧化为Mo5+,分别通过罗素机制和芬顿样反应与H2O2反应,触发了1O2和·OH的形成,而GPX4的表达下调。因此,LPO由于ROS爆发、GSH耗尽和GPX4失活而增强,从而导致铁死亡。MoO3−x-BG支架结合光子热疗与ROS触发的铁死亡,对OS表现出良好的治疗效果。更重要的是,工程设计的MoO3−x-BG支架促进rBMSC的分化和增殖,从而加速新生骨的再生。
文章来源:https://doi.org/10.1002/adfm.202304163