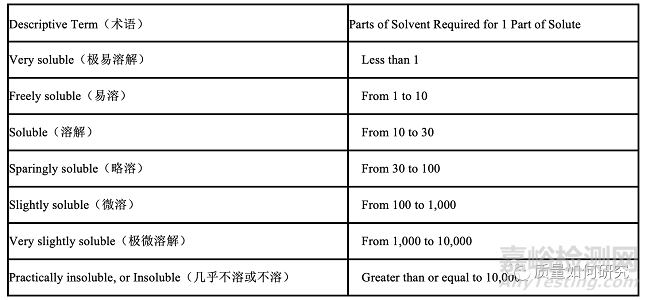
美国药典-处方集,是由美国药典委员会编写的。它分为两个部分,前面是USP,后面是NF。
美国药典是美国政府对药品质量标准和检定方法作出的技术规定,也是药品生产、使用、管理、检验的法律依据。NF收载了美国药典(USP)尚未收入的新药和新制剂。
USP-NF通常会每年更新。现在官方只提供在线版本(USP-NF Online),现行最新版为USP-NF 2022,Issue 3。USP–NF 2023, Issue 1, will become official on May 1, 2023.
凡例
1、与中国药典一致,凡例部分规定了USP-NF的基本假设、定义和默认条件。除另有规定外,凡例中的要求适用于所有药典中收录的品种正文和基本通则。
2、美国药典的全称是The Pharmacopeia of the United States of America and the National Formulary (USP–NF)。虽然USP和NF是共同发布且共用凡例,但它们是相互独立的。
3、当使用USP、NF或USP-NF这些描述且没有特别说明时,指的则是当前最新版本。
4、美国药典会持续修订,新增补内容会定期添加到USP-NF中。常规修订每年会发表3次,以USP-NF 2021为例,日期为
USP–NF 2021 Issue 1: Published November 1, 2020
USP–NF 2021 Issue 2: Published February 1, 2021
USP–NF 2021 Issue 3: Published June 1, 2021
5、药典的正文发表在https://online.uspnf.com网站。药典的常规修订会指定生效日期,通常在发布之日起的6个月后。快速修订则是为了更快地生效药典中的标准,发布之日起取代原先内容后立即生效。
6、定期的,与药典增修订相关的一个非正式卷会通过印刷或其他媒体发表。它的作用是作为一个历史参考文件而非正式文本。
7、正文是指被药典收录的内容。当它在一个各论中发表且有一个指定的生效日期时,即被视为认可和收录于药典中。
8、各论中指定的标题是正文的正式名称,不能用其它同义词代替。
9、正文包括活性物质和产品。其中:
活性物质是指原料药、辅料、膳食成分或其他组分,或成品设备的组件。
产品是指药品、膳食补充剂、复方制剂、或成品设备。
10、USP-NF药典中正文的标准会在各论、适用的通则和凡例中进行表述。各论中,正文的要求有两种表述方法:
对特定各论,在标题之后,文本主要信息部分描述完后会跟着一段要求文本,并通过“《 ”符号将后面这段内容引出。
对近期重新设计的各论,要求内容出现在标题和定义“Definition”之间。
11、无论何种格式,出现在这些地方的信息仅用于参考。
标题之后和“《 ”之前;
标题之后和定义之前;
辅助信息里面或后面。
12、适用的通则是指编号在1000以下或2000以上的通则,它通过引用凡例、各论或其他另一个编号小于1000的适用的通则使之适用于药典。
当某个各论的要求不同于凡例或通则的要求时,无论各论是否说明差异,均以各论中的要求为准。
编号在1000~1999的通则仅供参考。无论是否在编号小于1000的通则、各论或凡例中有被引用,它们包含的是药典中的非强制性测试、含量、或其他要求。
编号大于2000的通则仅用于准备用来当作膳食成分或补充剂的正文。
13、除非在发布时另有说明,否则 USP 允许在正式日期之前提前采用修订后的标准。
14、相关各论、通则和凡例中的标准在整个正文内容的生命周期内都适用,从发布生效起到过期失效。
15、为了保证产品按照要求贮藏,在规定的效期内符合药典标准,通常会遵循厂家的标准和生产规范。每个商业化的药典产品都应照此来构建,这样当用这些含量和检查方法检验时,它才能够符合药典要求。
16、一些测试(如溶出度和制剂含量均一性)需要多个计量单位与决策方案相结合。这些测试虽然使用了许多剂量单位,但实际上是一次测定。这些方法不应和统计抽样方案相混淆。与统计方法的相似的是,它似乎可以用来推断一些更大的单位组。但是,关于是否符合药典标准的陈述只是针对于测试的单位。
17、重复、平行、异常的统计拒绝、或外推结果到更大的样本,以及批检测的必要性和适当的频率,这些在药典中既未具体规定也没有禁止。这些决定主要是基于测试的目的。测试的频率和取样主要取决于执行符合性测试人员的偏好或决定,以及其他USP-NF的使用者,包括生产厂家、买家或监管机构。
18、适用的USP或NF标准适用于所有在美国上市的产品,包括:
收录在药典中的
准备用于或标记用于药品中的一个药品或一个组分。
这些产品(药品、原料药和辅料)包括了人用药物(无论是通过处方、非处方或其他方式分发)和兽用药物。
19、当某个产品标签上有“USP”,“NF”或“USP-NF”时,表示它符合美国药典的标准,字母应与产品标题一起出现。另外字母不能用圆圈、正方形等圈起来,且应大写。
20、各论规定了产品的名称、定义、质量标准以及与包装、贮藏和标签相关的其他要求。质量标准包括了检查项目,方法和可接受标准,有助于确保产品的特性、剂量,质量和纯度。
21、单个各论可能包括同一属性的多个测试、程序和验收标准。除非各论中另有说明,否则所有测试都是要求。在某些情况下,各论说明允许选择反映不同生产企业产品属性的测试,例如不同的多晶型、杂质、水合物和溶出度。
22、各项测试的排列顺序是按照相关专家委员会批准将其纳入各论的顺序。测试1不一定是针对原研或参比样品的测试。根据各论,如果使用测试1,通常不需要在标签上注明。
23、可接受标准中包括了分析误差,生产制造和复方组合中不可避免的变化,以及实际条件下可接受的恶化程度。药典可接受标准的存在不能作为说明一个纯度更接近100%的产品质量超过了药典质量的依据。同样的,当一个产品准备收紧各论中的药典标准时,也并不能作为说明这个产品超过了药典要求的依据。
24、每个通则都分配有一个数字,出现在通则名称的后面并用尖括号框住(如,色谱法<621>)。通则通常包括以下内容:
应用于各论的检查项目和方法描述
药物配制的条件和实践的描述和标准
解释药典要求的一般信息
一般药物储存、分发和包装实践的描述
给官方物质或产品制造商的一般指南
25、当各论中引用了一个通则,那么相应的可接受标准可能会出现在冒号之后。有一些通则可能只是作为一项测试或者分析技术的介绍性概述,那么它们可能会引用其他的包含技术、详细程序以及可接受标准的通则。
26、在药典中使用分子式是为了指定化学实体,类似于给出产品的完整化学名称,使其在规定强度时具有绝对的(100%)纯度。
27、如果由于添加物质的存在影响了药品的生物利用度,治疗效果或者安全性,或者干扰了确认符合标准的含量及测试时,那么它会被认为不适合包含在品种正文中而被禁止。
28、药品包装中的空气有时候会根据需要进行抽空或用二氧化碳、氦气、氩气或氮气以及这些气体的混合物所置换。这些气体的使用无需在标签中声明。
29、药典中仅允许包含指定的各论下批准的添加物质。此类添加物质不能超过发挥预期作用所需的量。如果批准了添加物质,那么标签上就需要注明每一个添加物质的名称和数量。
30、除非各论中另有规定,否则可以将合适的原料药和辅料,如抗菌剂、药物基质、载体、包衣、香料、防腐剂、稳定剂和媒介物添加到制剂产品中,以增强其稳定性、实用性、美观性或便于其制备。
31、根据FDA发布的有关使用色素的规定,仅用于赋予颜色的添加物质和辅料可以掺入用于肠胃外或眼科用途以外的官方产品中,前提是此类添加物质或辅料在所有方面都是合适的。
32、只有当各论中给出了一个定量溶解度测试并指定它为定量溶解度测试时,它才是一个纯度检查项。尽管各论中提供的信息和参考表中提供的信息可能间接有助于文章的初步评估,但它并不作为纯度的标准或测试方法。
33、药典中“鉴别”测试是用来确认药品的身份。特定产品的鉴别检查可能包含一个或多个程序。当进行鉴别检查时,必须所有指定流程的要求都满足才能满足测试要求。若未能满足所有要求,则表明产品贴错标签或者掺假了。
34、复方制剂的含量测试不是用来做分发前的评估,而是用来处理复方制剂是否符合药典标准的争议时作为官方测试。
35、杂质和异物的检查方法是将这些物质限制在药品日常使用时没有争议的量。
36、如果USP-NF的各论中包括了一个基于色谱方法的含量或有机杂质检测,它不是残留溶剂,并且各论程序中没有检测到物质中存在的杂质,杂质的数量和身份都是知道的,那么在产品标签(COA)的“其他杂质”项下应该进行说明。
37、药典中未标记的其他杂质,如果含量是0.1%或更大,是根据标准的不同而变化。除非各论另有规定,其他杂质加上各论中检出的杂质之和不得大于2.0%。
38、以下类别的原料药不包括在“其他杂质”要求中:
发酵产物和衍生的半合成产品,放射性药物,生物制品,生物技术衍生产品,肽,草药,动物或植物来源的粗产品。
39、任何被认为是有毒的物质不能被列在“其他杂质”项下。
40、所有USP和 NF制品均受到残留溶剂的相关控制,即使各论中未指定测试也是如此。如果在生产过程中使用溶剂,它们必须具有合适的质量。此外,应考虑每种溶剂的毒性和残留水平,并根据残留溶剂〈467〉中定义的原理和要求,使用其中介绍的一般方法或其他合适的方法限制溶剂。
41、官方药品中的元素杂质按照元素杂质—限量〈232〉中规定的原则和要求进行控制。
42、USP 标准品是经批准适用于 USP 或 NF 测试和分析的真实样品。如果USP或NF测试或测定要求使用USP标准品,则只有使用指定的USP标准品获得的结果才是决定性的。如果程序要求使用药典产品而不是USP标准物质作为参考物质标准品,则应使用符合该物品所有药典各论要求的物质。如果任何新的USP 或NF标准要求使用尚未提供的新USP标准品,则在指定的USP标准物质可用之前,包含该要求的标准品部分不能正式生效。
43、除非在个别各论或通则中另有说明,否则USP标准品应按照标准物质标签上的说明使用。