刚刚,国家药品监督管理局医疗器械技术审评中心发布《一次性使用血液透析器临床评价注册审查指导原则(征求意见稿)》,内容如下:
一次性使用血液透析器临床评价注册审查指导原则
(征求意见稿)
本指导原则旨在指导注册申请人对一次性使用血液透析器注册开展临床评价,同时也为技术审评部门审评一次性使用血液透析器临床评价资料提供参考。
本指导原则是对一次性使用血液透析器临床评价的一般要求,注册申请人需依据产品的具体特性确定其中内容是否合适。若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是对注册申请人和技术审评人员的指导性文件,但不包括审评审批所涉及的行政事项,亦不作为法规强制执行,需在遵循相关法规的前提下使用本指导原则。如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。
本指导原则是在现行法规和标准体系以及当前认知水平下制定,随着法规和标准的不断完善,以及科学技术的不断发展,相关内容也将适时进行调整。
一、适用范围
本指导原则适用于一次性使用血液透析器,包括低通量透析器和高通量透析器,在医疗机构用于急、慢性成人肾功能衰竭患者,进行常规的血液透析治疗。该产品分类编码为10-04-01,管理类别为三类。
二、临床试验基本要求
一次性使用血液透析器通常需通过临床试验路径进行临床评价,当注册申请人通过临床试验开展血液透析器的临床评价时,可参考本章要求开展临床试验。如注册申请人选择同品种路径进行临床评价,需满足本指导原则第三部分的相关要求,按照本导则第三部分内容提供相应资料。
(一)临床试验目的
临床试验需设定明确、具体的试验目的。申请人可综合分析试验器械特征、非临床研究情况、已在中国境内上市(下文简称已上市)同类产品的临床数据等因素,设定临床试验目的。临床试验目的决定了临床试验各设计要素,包括主要评价指标、试验设计类型、对照试验的比较类型等,进而影响临床试验样本量。
(二)临床试验设计类型
建议开展多中心临床试验,临床试验类型为前瞻性、随机对照。对照组一般选择透析参数和膜材料相似的透析器。
(三)入排标准
试验对象需具有代表性,对入选标准和排除标准需有详细说明。试验对象原则上需为开展维持期血液透析的慢性肾衰竭成年患者,标明年龄、性别、原发病、特殊要求等。排除标准通常包括试验对象伴有严重贫血,感染,肿瘤,活动出血,严重心、肝、肺脏疾病,精神异常或病情不稳定等患者等,或有其他不适合试验的情况,如产品有风险、对患者有伤害或影响疗效。
(四)评价指标
1.主要评价指标
低通量血液透析器主要评价指标包括肌酐清除率与尿素氮清除率,对于高通量血液透析器还包括β2微球蛋白(β2-MG)下降率。若注册申请人通过增大纤维膜的标称孔径等宣称扩大物质清除范围,除以上主要评价指标外,还需根据产品自身特点增加合适的主要评价指标并论述其选择的合理性,如考虑以λ游离轻链为代表的中分子物质的清除率作为主要评价指标之一。此时,需同时评价患者体内白蛋白的丢失情况,以白蛋白下降为主要评价指标,明确随访时间以及确定依据。
透析溶质清除率需平稳透析60min后,在固定工作状态下的血流量和透析液流量(通常设置超滤率0或者10mL/min),同时从透析器动静脉端抽血,检测肌酐、尿素氮、β2-MG或λ游离轻链等并计算清除率。通常按照如下公式进行计算:
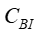 和
和 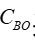 采用的浓度单位相同;
采用的浓度单位相同; 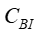 是指血液透析器血液入口的溶液浓度;
是指血液透析器血液入口的溶液浓度; 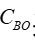 是指血液透析器血液出口的溶液浓度;
是指血液透析器血液出口的溶液浓度; 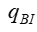 是指产品入口端的血液流速;
是指产品入口端的血液流速; 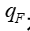 是指滤过液流速(超滤率)。
是指滤过液流速(超滤率)。
2.次要评价指标
2.1肌酐下降率、尿素氮下降率、以及适用时的代表性中分子物质的下降率。测定透析溶质下降率时,在透析开始和结束时抽血,停止超滤,血流量先减至100mL/min后,停泵立刻从患者体内抽血,透析溶质下降率=1-(透析后血浓度/透析前血浓度)%。
注:测定下降率时,在透析开始和结束时抽血,停止超滤,血流量先减至100mL/min后,停泵立刻从患者体内抽血。
2.2超滤率及超滤系数:超滤率(mL/h)=总除水量(mL)/治疗时间(h)。
2.3 C反应蛋白、透析开始时和透析15min后血气、透析开始后15min白细胞及血小板下降率等。
2.4血常规、肝肾功能、血电解质(包括血钾、血钙、血磷、HCO3-或CO2CP等)、白蛋白、球蛋白、C-反应蛋白。生命体征:血压、脉搏、体温、心率;患者一般状态:患者自我感觉、首次使用综合症及体征变化;与使用透析器相关的数据变化;与透析器功能相关的实验室参数。
2.5安全性指标:不良事件发生情况及严重不良事件发生情况,明确事件的具体信息如患者信息、发生时间、原因、后果、处理措施、患者转归及与器械的相关性等。
(五)并发症及处理预案(预计本试验中可能出现的并发症及如何处理)
包括透析中低血压、肌肉痉挛、恶心和呕吐、头痛、胸痛和背痛、皮肤瘙痒、失衡综合征、透析器反应(临床分为A型和B型反应)、心律失常、溶血、空气栓塞、发热、透析器破膜、体外循环凝血等。
(六)临床试验样本量
根据对照用血液透析器的相应指标的循证医学相关资料做出检验假设并计算样本量。同时,样本量的确定与选择的假设检验类型(优效、非劣效、等效性检验)及I、II类错误和具有临床意义的界值(疗效差)有关,同时还需考虑预计排除及临床失访的病例数。
临床试验样本量的确定需符合临床试验的目的和统计学要求,并且完成所有访视的受试者不应少于临床试验方案中规定的最低样本量。为保证各主要评价指标的检验功效均不低于80%,临床试验选择计算例数最多的主要评价指标的样本含量为临床试验样本量。临床试验如为非劣效设计,非劣效界值不大于主要评价指标平均水平的10%。若申报产品包含不同膜面积产品,建议注册申请人在1.5m2以及1.5m2-2.0m2区间内分别选择代表性产品进行样本量估计并开展临床试验。
三、同品种临床评价基本要求
以下两种情形下,血液透析器可通过同品种路径开展临床评价,一是申报产品使用的透析膜已在中国境内获准上市,注册申请人可选择具有相同透析膜的透析器作为同品种医疗器械;或二是申报产品的前代产品已在中国境内获准上市,申报产品是对前代产品透析膜壁厚及纹理/波形进行改变,注册申请人可选择前代产品作为同品种医疗器械。此时,血液透析器同品种临床评价相关要求如下:
(一)适用范围及临床使用相关信息的对比
申报产品与同品种医疗器械需有相同的适用范围,需比对的信息包括适用范围、适应证、适用人群及使用时间等。
(二)技术特征的对比
1. 结构组成
注册申请人需对比申报产品与同品种医疗器械的结构组成,关注透析膜材料和设计特征的对比,其包括但不限于透析膜材料、透析膜面积大小、纤维数量、有效纤维长度、纤维内径、纤维壁厚、纤维膜标称孔径大小及分布范围、孔隙率等。
2.性能指标
申报产品与同品种医疗器械需在同等的检测条件下进行性能检测,若申报产品包括不同膜面积,按照膜面积<1.5m2,1.5m2-2.0m2分别进行性能测试。透析器性能参数的比对建议重点考虑以下内容(包括但不限于):
2.1.清除率:常用尿素、肌酐、磷酸盐、维生素B12的清除率评价透析器的滤除性能,对于高通量透析器,还需比对申报产品与同品种产品β2-MG的清除率。若注册申请人通过增大纤维膜的标称孔径等扩大物质清除范围,还需根据产品自身特点增加合适物质的清除率并论述其其选择的合理性,如考虑以λ游离轻链为代表的中分子物质的清除率。
测定清除率需覆盖注册申请人申报的血液流速和透析液流速范围。相关物质的清除率测定可选择透析液流速的最低和最高点,并分别对应注册申请人申报的血液流速的最低流速、每增加100mL/min的血液流速,直至最高血液流速。
2.2.超滤率与超滤系数:超滤率可评价血液透析器对水的清除能力。测定超滤率需覆盖注册申请人申请的跨膜压(TMP)和血液流速的范围。将测定的多个超滤率及其对应的TMP进行线性回归,以计算超滤系数。如高通量透析器,可在600-1800mL/h超滤率范围内,测定至少4个数据点的超滤率并记录该超滤率下的TMP,通过超滤率与TMP的斜率来计算其超滤系数。
2.3.压力降:测定压力降需覆盖注册申请人申请的血液流速及透析液流速范围。建议在血液流速为100mL/min、200mL/min、300mL/min、400mL/min时测量血液侧的压力降;在透析液流速为500mL/min、600mL/min、700mL/min、800 mL/min时测量透析液侧的压力降。当最高血液流速和最高透析液流速与上述建议值不同时,还需分别测量最高血液流速和最高透析液流速下的压力降。
2.4. 筛选系数:高通量透析器还需测定筛选系数。建议在血液流速为 200mL/min、300mL/min、400mL/min、500mL/min以及最大流速(当与上述流速不同时)时测量白蛋白、菊粉、肌红蛋白或β2-MG的筛选系数。
(三)差异性部分的安全有效性证据
1. 申报产品为新注册产品,其使用的透析膜已在境内获准上市,注册申请人选择具有相同透析膜的透析器作为同品种医疗器械时,注册申请人需按照上述要求进行结构组成、透析膜材料和设计特征以及相关性能指标的对比,在充分识别申报产品与同品种医疗器械相同性和差异性的基础上,论证二者的等同性。如申报产品的设计影响血液流动模式,或是最大血液流速与同品种医疗器械存在明显差异,申请人需提供最大血液流速下机械性溶血测试数据,以验证该设计不会引起红细胞的过度溶解。建议在最大血液流速下进行测试。
2. 申报产品的前代产品已在中国境内获准上市,申报产品是对前代产品透析膜的壁厚及纹理/波形进行改变,注册申请人选择前代产品作为同品种医疗器械,在结构组成、透析膜材料和设计特征以及相关性能指标对比的基础上,还需针对差异部分开展临床试验,以确认血液透析器的临床性能。
2.1总体要求:通过12名受试者接受总计36次治疗的数据,验证血液透析器的临床性能。如申报产品包括不同膜面积,建议在膜面积<1.5m2以及1.5m2-2.0m2范围内各自选择代表性产品,分别开展临床试验,
2.2评价指标
2.1.1超滤率和超滤系数:每名受试者测定4个数据点的超滤率,通过线性回归计算超滤率与其对应的TMP的斜率,获得体内超滤系数。例如对于高通量透析器,在预先设定的时间点,超滤率分别为600mL/h、1000mL/h、1400mL/h、1800mL/h,5分钟之后记录实际TMP。通过12例受试者的超滤系数,反映透析器体内的超滤系数,以体内外外超滤系数的百分比评价体内外超滤系数的一致性。
2.2.2尿素氮、肌酐、磷酸盐清除率、β2-MG下降率(高通量透析器)。
2.2.3透析开始后15min白细胞、血小板下降率,透析开始时和开始后15min的血气分析,透析前后的红细胞、白细胞、血小板变化情况。
2.2.4不良事件的发生情况、处理方式及处理结果,包括补体激活和血栓形成等。
2.3数据分析及结论
注册申请人需对临床试验结果进行分析,评价产品的临床性能。
(四)同品种产品的临床数据
建议参考《医疗器械临床评价技术指导原则》要求,提交同品种产品的临床数据;临床试验或临床使用获得的数据(以下简称临床数据)可来自中国境内和/或境外公开发表的科学文献和合法获得的相应数据,包括临床试验数据、临床经验数据、临床文献数据等。临床文献数据的收集应保证查准、查全,具有可重复性;临床经验数据收集应包括对已完成的临床研究、不良事件、与临床风险相关的纠正措施等数据的收集。注册申请人可依据产品的具体情形选择合适的数据来源和收集方法。
同品种医疗器械临床数据需在国内现行血液透析操作规范的条件下(特别是血液流速与治疗次数)收集。
四、参考文献
[1]《医疗器械临床评价技术指导原则》(2021年第73号通告)[Z].
[2]《决策是否开展医疗器械临床试验技术指导原则》(2021年第73号通告)[Z].
[3]《医疗器械临床试验设计指导原则》(2018年第6号通告)[Z].[4]《医疗器械临床评价等同性论证技术指导原则》(2021年第73号通告)[Z].[5]《医疗器械注册申报临床评价报告技术指导原则》(2021年第73号通告)[Z].
[4]《一次性使用透析器产品注册技术审查指导原则》(2013年第3号通告)[Z].
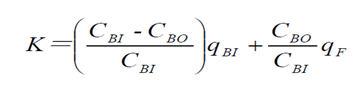
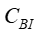 和
和 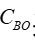 采用的浓度单位相同;
采用的浓度单位相同; 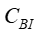 是指血液透析器血液入口的溶液浓度;
是指血液透析器血液入口的溶液浓度; 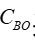 是指血液透析器血液出口的溶液浓度;
是指血液透析器血液出口的溶液浓度; 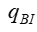 是指产品入口端的血液流速;
是指产品入口端的血液流速; 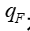 是指滤过液流速(超滤率)。
是指滤过液流速(超滤率)。


