摘要:2019 年《药品管理法》明确规定境外持有人应当设置境内代理人,履行相关义务并承担连带责任。本文采用文献研究法、比较研究法、访谈调研法,在梳理我国过去进口药品代理人管理历程、境内代理人设立的背景和目的、欧美日国家代理人管理现状的基础上,对新法背景下境内代理人的性质、责权利展开分析。我国境外持有人的境内代理人并非民法制度意义上的代理人,而是《药品管理法》语境下的代理人。设立境内代理人本质上是为了契合以持有人为主线的全生命周期管理,境内代理人与境外持有人在民事责任上连带,其行政和刑事责任则受到药事法律规章的约束。因此,境内代理人的制度设计中需要考虑代理人的责权匹配,以促进制度更好地实施。
2019 年《中华人民共和国药品管理法》(以下简称《药品管理法》)全面实施药品上市许可持有人(Marketing Authorization Holder,MAH),并将其作为基本制度、核心制度,贯穿于整部《药品管理法》。2020 年国家药品监督管理局(以下简称国家药监局)综合司发布《境外药品上市许可持有人境内代理人管理暂行规定(征求意见稿)》,征求意见稿中就境内代理人的定义、条件、责任义务、监管等事项进行了规定。境内代理人制度是《药品管理法》下新增的规定,本文拟对进口药品代理人管理历程、境内代理人设立的背景和目的、欧美日国家代理人管理现状及我国境内代理人的性质、责权利等展开分析,以期完善我国境内代理人的管理。
一、新旧《药品管理法》下关于进口药品境内代理人的管理情况
1.1 2001 年《药品管理法》下进口药品代理人的管理情况
1.1.1相关法律规定
2001 年《药品管理法》实施时,我国尚未实施 MAH 制度。但针对进口药品,由于生产场地在境外,其实质上实施的是 MAH 制度。在进口药品管理方面,2002年、2007 年《药品注册管理办法》对进口药品提交药物临床试验申请、药品上市申请进行了明确规定。同时,2003 年《药品进口管理办法》明确了药品进口备案、报关、口岸检验等事项。
此时《药品管理法》中对于进口药品没有明确的代理人的要求。其中,1999年《药品流通监督管理办法》(暂行)【失效】中规定,已获《进口药品注册证》的进口药品在国内市场销售,国外制药厂商必须选定中国合法的进口药品国内销售代理商,国内销售代理商必须向国家药监局备案。销售代理商指取得《药品经营企业许可证》的企业法人,依据其与国外制药厂商之间所签订的协议,从事进口药品国内销售代理等业务的药品经营企业。国内销售代理商又被称为国内总代。此后又相继出现过注册代理人、质量管理代理人等多种代理人角色,依据双方之间的合同约定,负责代为办理注册、质量管理等事项[1]。
1.1.2 实践中的管理情况
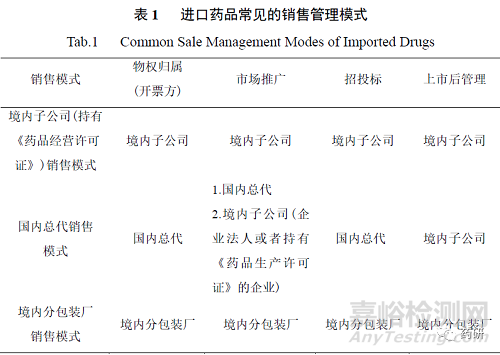
根据前文规定可知,过去进口药品没有严格法律意义上的代理人,但是境外持有人会根据自身品种特点,国内销售代理商的销售实力、渠道资源、学术推广能力、市场信誉等选择合适的销售代理商。国内销售代理商可能由境外持有人在中国境内设立的、持有《药品经营许可证》的子公司担任,也可以是国药控股、上海医药、华润医药、九州通等流通企业担任。境外持有人与国内销售代理商签订销售协议,由其负责产品的进口备案、报关、销售代理等工作。需要注意的是,国内销售代理商以自身名义开票,故国内销售代理商本质上是经销的概念,而非代理概念。
此时进口产品在中国市场的学术推广工作可能由国内销售代理商承担,也可能由境外持有人在境内设立的子公司承担。在药品上市后管理方面,主要包括不良反应监测、质量投诉及召回等,往往由境外持有人在境内设立的子公司承担,国内销售代理商予以配合协助,比如国内销售代理商负责通知子公司流通环节的投诉、进行必要的调查、配合召回等,同时境外持有人也会协调相关工作。
针对进口分包装产品,根据 2007 年《药品注册管理办法》的规定,接受分包装的药品生产企业应当提交补充申请,取得《药品补充申请批件》和药品批准文号。实践中由于进口分包装企业持有药品批准文号,故通常由其负责品种的进口和销售、学术推广、招投标及品种上市后管理工作[2]。进口药品常见的销售管理模式如表 1 所示。
1.2 2019 年《药品管理法》下境外持有人的境内代理人管理情况
1.2.1 相关法律规定
2019 年《药品管理法》全面实施 MAH 制度。随着 2020 年《药品注册管理办法》的实施,我国不再区分国产药品和进口药品,统一划分为境内生产的药品,境外生产的药品。现阶段有两种情况,境内生产的药品,持有人在境内;境外生产的药品,持有人在境外,后者即对应此前的进口药品[3]。
根据 2019 年《药品管理法》第三十八条规定,药品上市许可持有人为境外企业的,应当由其指定的在中国境内的企业法人履行义务,与药品上市许可持有人承担连带责任;第一百三十六条规定,药品上市许可持有人为境外企业的,其指定的在中国境内的企业法人未依照本法规定履行相关义务的,适用本法有关药品上市许可持有人法律责任的规定。即《药品管理法》首次从法律层面明确要求境外持有人应当设立中国境内的企业法人,履行《药品管理法》规定的义务,承担连带责任。
2020 年 8 月国家药监局综合司就《境外药品上市许可持有人境内代理人管理暂行规定》征求意见,将境外持有人设立的中国境内企业法人定位为境内代理人,并规定了境内代理人的定义、条件、义务、监管等事项。
境外持有人的境内代理人条件:①中国境内设立的企业法人;②具有与从事代理工作相适应的质量管理制度,以及与其承担责任相适应的质量管理体系;③具有与从事代理工作相适应的办公场所、通信方式、联系电话;④具有能够确保产品可追溯的管理系统。
境外持有人的境内代理人义务:①负责建立药品质量保证体系;②负责建立并实施药品追溯制度;③负责建立并实施药品年度报告制度;④负责建立药品上市后的变更管理制度;⑤承担药品上市后召回、质量投诉、质量赔偿等事宜;⑥负责建立药物警戒体系;⑦负责提交药品标准物质;⑧负责与境外持有人联络。
2022 年 5 月国家药监局综合司就《中华人民共和国药品管理法实施条例》征求意见,规定了境内代理人的指定与变更事项,包括指定时间、是否载入药品注册证书、境内代理人的条件、境内代理人的登记及变更管理等内容。
1.2.2管理的目的
我国 MAH 制度实施前,进口药品实行的也是持有人制度。如前文分析所述,进口药品过去管理中存在国内销售代理商或者注册代理人等,但法律层面对于代理人并无明文规定。在 MAH 制度实施后,《药品管理法》强调以持有人为主线,落实药品全生命周期管理,由持有人对药品的安全性、有效性、质量可控性负责。此时境内代理人的提出也是契合了境外持有产品的全生命周期管理。通过以境内代理人为主线,加强上市后管理及责任落实,解决由于持有人在境外,监管措施非常有限,特别是遇到召回、不良反应监测、监督抽验等与境外企业沟通联系获取资料难、查处难和追责难等问题。《药品管理法》中要求代理人与境外持有人承担连带责任,并在法律责任章节规定当代理人没有依法履行相关义务,适用持有人的法律责任,即代理人直接受到《药品管理法》的约束,需要承担相应的行政责任和刑事责任。此举一方面能够更好地保障患者的合法权益,另一方面通过将代理人纳入药监部门的监管对象中,更好地保障药品上市后管理责任的落实。但是,目前法律层面仅提出了境外持有人设立境内企业法人(境内代理人)的要求,关于目前境内代理人的资质、责任义务及其享有的权利仍然有待进一步明晰。
二、欧美日国家有关代理人的管理情况
欧盟、美国、日本均实行 MAH 制度,同时也具有各国的特色。欧盟、日本要求持有人必须相对应地在欧盟、日本境内,生产场地可以在境内或者境外。美国规定持有人可以在美国境内或者境外,生产场地也可以在境内或者境外[4]。
2.1日本管理情况
日本采取的是资格准入型的 MAH 制度,企业必须首先取得相应类别的销售企业许可证(分为处方药、除处方药之外的药品、药妆、化妆品四类),方可申请药品上市许可,并在获批后成为持有人。日本持有人必须在日本境内,符合药物质量管理规范和药物警戒质量管理规范的要求,必须根据医药产品的风险级别雇佣三名有资质的全职管理者,即总销售合规官、质量保证主管、上市后安全控制主管,全面负责药品生产销售管理。因此日本并没有设置代理人制度。
2.2欧盟管理情况
根据《欧共体人用药品注册指令》(2001/83/EC 指令),欧盟持有人可以指定当地代表,并在药品标签中标注,但不能免除持有人的任何法律责任。当地代表应当隶属于欧盟成员国或欧盟经济区国家,能够用当地语言与医疗保健专业人员或者患者联系,负责处理产品质量问题及投诉等[5]。
2.3美国管理情况
当持有人在美国境外、且在美国境内没有居住点或者营业地点时,需要指定一个美国代理人,该代理人拥有营业场所及合法地址,负责境外持有人与 FDA的沟通,包括:①审查、分发、发送和回应所有来自 FDA 的通信,包括紧急通信;②回答有关进口或准备进口到美国的药品问题;③协助 FDA 安排检查;④如果 FDA 不能直接或迅速联系到境外持有人,FDA 可以向美国代理提供信息或文件。FDA 向美国代理提供的信息或者文件等同于向境外持有人提供的信息或文件。
因此,欧美日国家均是结合自身国情实施相应的持有人制度。欧盟虽设有代表、美国设有代理人,但是代表、代理人仅负责联络、处理部分管理事项,不承担连带责任,代表、代理的设置也不能因此免除持有人的任何法律责任。
三、关于我国 MAH 制度下境外持有人的境内代理人的理论分析
3.1《民法典》中代理制度
根据《民法典》,所谓代理制度,是指代理人在代理权限范围内,以被代理人的名义与第三人实施民事法律行为,对被代理人发生效力的民法制度。代理制度属于私法自治的扩张,使民事主体不仅可以利用自己的能力和知识参加民事活动,而且可以利用他人能力和知识进行民事活动,从而扩张民事主体从事民事活动的范围,降低交易成本,为民事主体更好地实现自己的权利、参与社会经济活动提供极大的便利[6]。
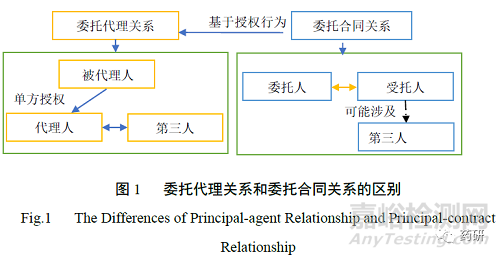
依据代理权的取得方式,代理分为委托代理和法定代理,委托代理又称意定代理、授权代理。委托代理是基于被代理人的授权行为,授权行为本身是一个单方意思表示行为,其产生的基础法律关系通常来源于委托合同,也可能来源于劳动合同、合伙协议等。即委托代理关系和委托合同关系并不能直接画等号。
委托代理和委托合同关系的主要区别如下。①是否以被代理人或者委托人名义。委托代理中,代理人从事民事法律活动一般只能以被代理人的名义进行,不得以自己的名义进行。代理行为的法律后果直接由被代理人承受。委托合同中,受托人可以以自己的名义从事民事活动,也可以以委托人的名义从事民事活动,以谁的名义并不是问题的关键。②从事行为范围及涉及第三人。委托代理中,经授权的代理人仅能代理本人从事民事法律行为和准法律行为。并且,代理人实施的行为通常涉及第三人。委托合同中,受托人既可以从事民事法律行为,也可以从事民事事实行为。为处理委托事项,受托人可能与第三人为某种法律行为,也可以仅处理某项事实行为[7]。
3.2 我国 MAH 制度下境内代理人的性质、资质、责任与权利分析
3.2.1 境内代理人的性质
从《药品管理法》及《境外药品上市许可持有人境内代理人管理暂行规定》(征求意见稿)看,药品境外持有人的境内代理人主要协助境外持有人履行上市后管理义务,包括年度报告、变更、上市后召回、投诉等,并不必然涉及注册代理事项,也不必然涉及销售代理事项。这也说明境内代理人本质上是受到境外持有人的委托,履行上市后管理义务,双方之间属于委托合同关系。当然,境内代理人在处理上市后管理事项时,可能需要以境外持有人的身份与药品监管部门联络,此时可能需要得到境外持有人的单方授权,继而产生委托代理关系。需要注意的是,《民法典》中的代理制度不存在连带责任之说,代理人以被代理人的名义与第三人实施民事法律行为,法律后果直接归属于被代理人。所以,药品境外持有人与境内代理人之间不是民法制度意义上的代理行为,而是《药品管理法》语境下的代理,其名为境内代理人,实则属于境内责任人,需要履行药事法律规章下规定的责任和义务。
3.2.2 境内代理人的资质
根据药事法律规章的规定,境内代理人需要履行药品上市后管理义务,与境外持有人承担连带责任。故理论上境内代理人也应当需要具备质量管理、风险防控、责任承担三大能力,建立与其代理工作相适应的质量保证体系,如此方能更好地履行上市后管理义务。《药品管理法实施条例(征求意见稿)》规定境内代理人应当向省级药品监督管理部门登记,并未对境内代理人增设行政许可。此举符合“简政放权、深化放管服”改革的总体趋势,同时也要求境外持有人应当谨慎遴选、审计境内代理人的资质,确保其具备履责的能力。相比于将境内代理人在药品注册证书中载明,在药品包装、标签、说明书中载明更有利于对外公告境内代理人、落实境内代理人上市后管理职责。至于是在药品批准前或者药品批准后确定境内代理人,理论上应当根据境外持有人开拓市场的能力和进程选择确定,当然统一规定在药品批准前或者批准后确定更便于国家药品监管部门对境内代理人的统一管理。
3.2.3 境内代理人的责任
关于境内代理人承担的责任,包括积极责任和消极责任。积极责任方面,前文已有描述,主要涉及上市后管理义务。消极责任方面,包括民事责任、行政责任、刑事责任。首先,在民事责任方面,主要涉及药品缺陷致人损害的赔偿责任,境内代理人应当与境外持有人对外承担连带责任,对内可给予过错责任追偿。由于药品责任风险属于典型的“长尾风险”,即从事故发生到发现损害后再提出索赔,可能经历几年甚至几十年的时间。这客观上要求监管者在制度设计上,以及境内代理人和境外持有人在内部约定上,都需要考虑产品售后索赔、追偿等事项。
其次,在行政责任和刑事责任方面,均不存在连带之说法。在行政责任方面,境内代理人应当履行药事法律规章规定的责任和义务,并承担未履行义务可能造成的行政责任。在刑事责任方面,典型罪名为生产、销售、提供假药/劣药罪,妨害药品管理罪。其一,生产、销售、提供假药/劣药罪客观方面表现为生产、销售、提供假药行为,若代理人未持有《药品经营许可证》则不可销售所代理品种时,谈不上生产、销售、提供假药/劣药罪;若代理人持有《药品经营许可证》可销售所代理的品种,则可适用《中华人民共和国刑法》《药品管理法》中销售者相关规定。其二,针对妨害药品管理罪,若代理人未代办理注册事项,则不会涉及提供虚假证明等骗取许可的妨害药品管理罪情形;若代理人代理注册事项,明知是提供虚假证明等骗取许可,可能构成妨害药品管理罪的共犯,需要承担相应的刑事责任。
再者,需要注意的是,因境内代理人设置的本质是为了落实药品上市后管理责任,同时避免由于持有人在境外追责难的问题,所以当行政责任、刑事责任涉及罚款、罚金时,可将境内代理人设为处罚对象,由境内代理人缴纳罚款或者罚金,此后境内代理人可基于与境外持有人的委托合同约定进行内部追偿。
3.2.4 境内代理人的权利
药品是特殊的商品。《中华人民共和国产品质量法》第四十一条、四十二条规定产品存在缺陷造成人身、缺陷产品以外的其他财产的损害,生产者承担无过错赔偿责任;销售者承担过错赔偿责任。2009 年通过的《侵权责任法》【废止】中增加了因药品缺陷致人损害,患者可以向医疗机构请求赔偿,医疗机构赔偿后再向有责任的生产者追偿。2019 年《药品管理法》在赔偿主体中增加了 MAH,同时规定境外持有人的境内企业法人(境内代理人)也应当承担连带责任。此时需要思考的是,若境内代理人并非产品的销售者,也非持有人、生产者、使用者(提供者),其不直接经手产品,不享有产品的销售收益,让其承担民事连带责任是否合理?当然,《药品管理法》要求代理人承担民事连带责任更有利于保障患者的权益。关于责权是否匹配的问题需要在后续制度设计或者境外持有人与代理人的约定中予以考量。
当境内代理人未持有《药品经营许可证》,不得销售代理的产品时,此种情形对现有药品经营制度的影响最小。此时实际上没有改变进口产品销售管理模式,仍然由境外持有人在中国境内设立的、持有《药品经营许可证》的企业或者药品流通企业担任国内销售代理商,负责产品进口、销售,同时增加了境外持有人的境内代理人的这一角色,需要境内代理人建立质量保证体系,与国内销售代理商密切沟通,掌握产品上市后销售流向,做好药品上市后追溯、药物警戒、召回等事项。此外,若允许未持有《药品经营许可证》的境内代理人销售代理产品,此时代理人类似于境内持有人,若自行销售代理的产品,需要符合《药品管理法》规定的经营条件,若自行零售产品,需要取得《药品经营许可证》。此时需要考虑是否需要类似于对境内持有人的管理,给境内代理人发证的问题。
再者,当境内代理人持有《药品经营许可证》可以销售产品时,还需要考虑境内代理人与国内分包装厂的关系。根据 2020 年 8 月国家药监局药品审评中心发布的《境外生产药品分包装备案程序和要求》,进口分包装产品由注册改为备案管理,由境内代理人向国家药监局备案,并不再核发药品批准文号。此时,境外持有人能否自由选择由境内代理人或者国内分包装厂销售产品也需要进一步明确。
四、结语
境外持有人的境内代理人管理是我国 MAH 制度下新增的一项规定,本质上是为了契合以持有人为主线的药品全生命周期管理。通过落实境内代理人的职责,加强对境外持有人持有品种的管理,解决由于持有人在境外,监管措施非常有限,获取资料难、查处难和追责难等问题,更好地保障患者的权益。境内代理人并非民法制度意义上的代理人,而是《药品管理法》语境下的代理人。境内代理人与境外持有人在民事责任上连带,行政和刑事责任则受到药事法律规章的约束。境内代理人制度在设计中需要考虑境内代理人责任和权利的匹配,以促进境内代理人制度更好地实施。