一、自膨式可载粒子胆道支架的产品结构及组成
该产品由内、外支架组成,各带有一个一次性使用置入器。外支架带有粒子囊。一次性使用置入器由软头、内管、中管、外管、前手柄、后手柄、助推管等组成。产品环氧乙烷灭菌,一次性使用,货架有效期 2 年。
二、自膨式可载粒子胆道支架的产品适用范围
该产品用于因恶性肿瘤导致的无法手术或者不愿手术切除的胆道狭窄/梗阻的扩张及治疗。
三、自膨式可载粒子胆道支架的工作原理
该产品在内窥镜和/或 X 射线的引导下,将支架放置至梗阻部位进行扩张引流,同时利用放射性粒籽源 125I(不包含在产品中)进行管腔内近距离放疗,以抑制和破坏肿瘤细胞的生长。
四、自膨式可载粒子胆道支架的产品技术要求研究
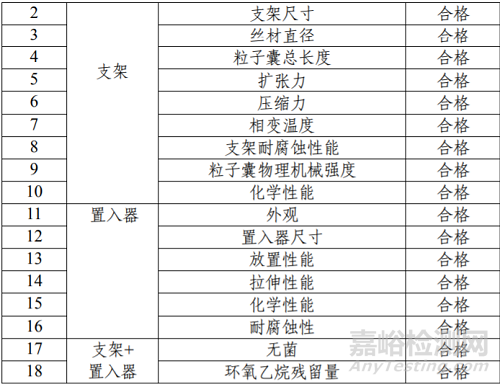
产品技术要求研究项目如表 3 所示。
表 3 产品技术要求研究项目摘要
五、自膨式可载粒子胆道支架的产品性能研究
产品性能评价包括支架长度、直径、置入器尺寸、扩张力、压缩力、相变温度、显微组织、耐腐蚀性能、支架抗弯曲性能、模拟与体内解剖和病变特征一致的体外模型测试、粒子囊物理性能、硅橡胶材料化学性能研究、MRI 兼容性研究、置入器放置性能、拉伸性能等。此外,开发人开展了产品在胆道内移位、疲劳、磨损的运动学评估,分析了支架设计故障模式、开展了模拟胆汁环境中耐腐蚀性能验证、粒子囊分布合理性评估、125I 粒子装填后效应关系和能量安全评估、125I粒子空气中及粒子囊内放射量衰减测试、镍离子释放研究。结果表明产品符合设计输入要求。
六、自膨式可载粒子胆道支架的生物相容性研究
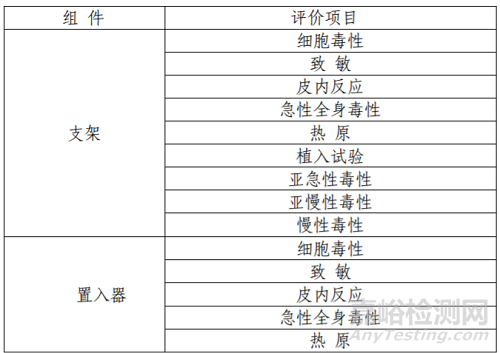
该产品包含支架和输送系统(置入器)两部分。支架为植入器械,与组织长期接触;输送系统为外部接入器械,与组织短期接触;开发人对植入器械及外部接入器械按照 GB/T 16886.1 标准要求进行了生物相容性评价,证实该产品生物相容性风险可接受。
表 4 生物相容性试验项目
七、自膨式可载粒子胆道支架的灭菌研究
该产品采用环氧乙烷灭菌,无菌状态提供。开发人开展了灭菌确认研究,证明无菌保证水平可达 10-6,环氧乙烷残留量不大于 10μg/g。
八、自膨式可载粒子胆道支架的产品有效期和包装研究
产品货架有效期为两年。开发人开展了货架有效期验证,验证方式为加速老化验证,包括产品稳定性、包装完整性和运输模拟验证研究。
九、自膨式可载粒子胆道支架的动物研究
动物研究为评价自膨式可载粒子胆道支架在比格犬动物模型中的有效性和安全性。对支架植入即刻、植入后 2 个月、4 个月、6 个月分别进行观察(组别:低剂量、中剂量、高剂量、对照组),评估产品的可行性、安全性、有效性等。研究结果表明:该手术方式可行,置入后未见放射源泄露、未见血液系统及免疫系统异常、支架置入部位的胆管组织及其周围的肝脏、门静脉、局部肠管及胰腺组织的肉眼和光、电镜观察结果与对照组未见明显区别。产品符合预期设计要求。