您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2023-04-10 14:45
近日,广州市达瑞生物技术股份有限公司研发的“二十项遗传性耳聋基因突变检测试剂盒 (飞行时间质谱法)”获批上市,下面嘉峪检测网与您一起了解一下二十项遗传性耳聋基因突变检测试剂盒 (飞行时间质谱法)在临床前研发阶段做了哪些实验。
1、二十项遗传性耳聋基因突变检测试剂盒 (飞行时间质谱法)的主要组成成分
产品主要组成成分见下表
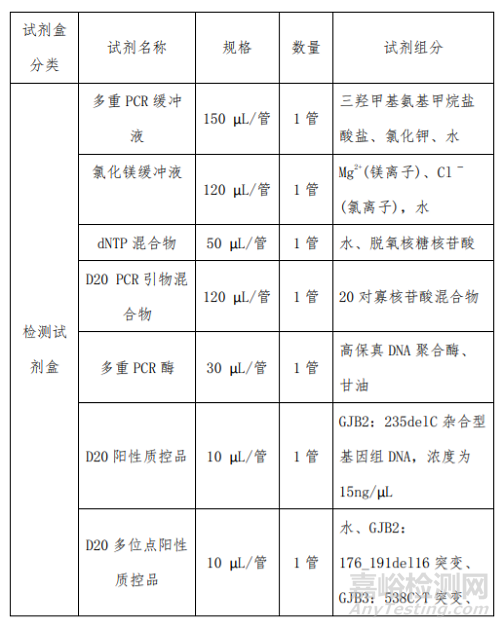
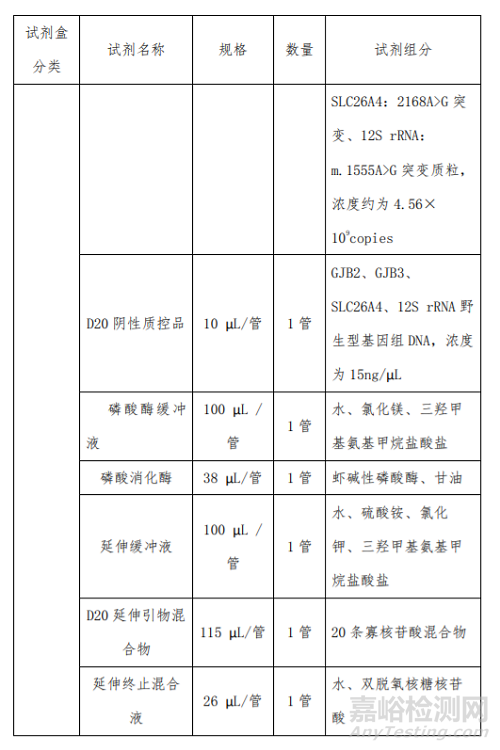
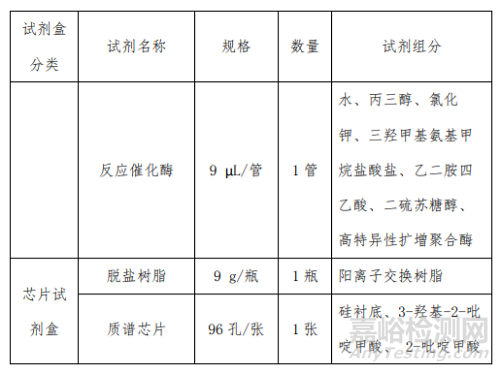
2、二十项遗传性耳聋基因突变检测试剂盒 (飞行时间质谱法)的预期用途
本产品用于定性检测人外周全血样本中人基因组 DNA 中 4 个遗传性耳聋相关基因的 20 个突变位点,包括 GJB2 上 的 35 del G、176_191 del16、235 del C、299_300 del AT、 167delT,GJB3 上的 538C>T、547G>A,SLC26A4 上的 IVS7- 2A>G、2168A>G、281C>T、589G>A、1174A>T、1226G>A、 1229C>T、IVS15+5G>A、1975G>C、2027T>A、2162C>T, 和线粒体 12S rRNA 上的 m.1555A>G、m.1494C>T。 7 本产品用于遗传性耳聋的辅助诊断。
本产品的检测结果 仅代表对相关位点的检测,不能作为患者是否有遗传性耳聋 倾向的诊断和排除的唯一指标,检测结果仅供临床医生参考, 如需确诊病例,请结合临床症状及其他检测手段综合进行评 估,检测结果不得作为临床诊治的唯一标准。
3、二十项遗传性耳聋基因突变检测试剂盒 (飞行时间质谱法)的检验原理
根据所选择的多态性位点设计多重 PCR 特异性扩增引物和延伸引物,PCR 反应扩增包含多态性位点的基因序列, 特异延伸引物在 SNP 位点上延伸 1 个碱基,样本经特定处理 后与芯片基质共结晶,瞬时纳秒(10-9 s) 强激光激发,基质将 吸收的激光脉冲能量转移给待分析样本,按质荷比加以分离。 离子捕获仪收集并储存脉冲信号,并对其进行质谱分析,通 过比较 A、T、G 和 C 的信号强度及毗邻信号间质量的差异 ( ddATP=271.2Da , ddCTP=247.2Da , ddGTP=287.2Da , ddTTP=327.1Da) 可得出模板序列的信息。
4、二十项遗传性耳聋基因突变检测试剂盒 (飞行时间质谱法)的主要原材料研究
4.1 主要原材料的选择
本产品在制备过程中主要原材料包括检测试剂中的多重 PCR 缓冲液、氯化镁缓冲液、dNTP 混合物、PCR 引物、 8 多重 PCR 酶、磷酸酶缓冲液、磷酸消化酶、延伸缓冲液、延 伸引物、延伸终止混合液、反应催化酶、D20 阳性质控品、 D20 多位点阳性质控品、D20 阴性质控品;芯片试剂中的脱 盐树脂和质谱芯片等。
主要原材料中 D20 阳性质控品为含 GJB2:235delC 突变 杂合体的基因组 DNA;D20 多位点阳性质控品为含 GJB2: 176_191del16 突变、GJB3:538C>T 突变、SLC26A4:2168A>G 突变、12S rRNA:m.1555A>G 突变位点的质粒,由开发人设计后由专业的合成公司合成;D20 阴性质控品为本试剂盒检 测范围内 20 个位点野生型的基因组 DNA;PCR 引物、延伸 引物为开发人自行设计后由专业的合成公司合成;其余主要 原材料均为外购方式获得。
开发人选择有资质的供应商提供原料,通过功能性试验筛选出最佳原材料和供应商,制定了 各主要原材料质量要求并经检验合格。
4.2 企业参考品和质控品设置情况
企业参考品包括阳性参考品、阴性参考品、检测限参考 品和重复性参考品。
阳性参考品共 23 份,涵盖该产品可检出的所有突变类型。其中,17 份由对应的型别突变的全血基因组 DNA 制备而成,6 份由对应的突变型质粒 DNA 和野生型人类基因组 DNA 按拷贝数混合制备而成;阴性参考品 10 份,其中 3 例 9 由试剂盒检测范围内 20 个位点野生型全血样本基因组 DNA 制备而成,4 例由地贫突变位点全血样本基因组 DNA 制备而 成,3 例由试剂盒检测范围外的人耳聋基因突变全血样本基 因组 DNA 制备而成;最低检测限参考品 23 份,涵盖该产品 可检出的所有突变类型。其中,15 份由对应的型别突变的全血基因组 DNA 制备而成,2 份由野生型人基因组 DNA 和相 应型别突变全血基因组 DNA 制备而成,6 份由对应的突变型 质粒 DNA 和野生型人类基因组 DNA 按拷贝数 1:1 混合制备 而成;重复性参考品 3 份,由对应的型别突变的全血基因组 DNA 制备而成。
试剂盒包含 2 份阳性质控品和 1 份阴性质控品,用于检测过程的质量控制。其中,D20 阳性质控品由一定浓度的 GJB2:235delC 杂合型基因组 DNA 组成,D20 多位点阳性质控品由重组质粒组成,阴性质控品由试剂盒检测范围内 20 个位点野生型的基因组 DNA 制备而成。
5、二十项遗传性耳聋基因突变检测试剂盒 (飞行时间质谱法)的生产工艺和反应体系研究
开发人对试剂盒反应体系的研究中包括:多重 PCR 酶用 量的优化、PCR 扩增条件优化、多重 PCR 引物浓度、优化磷酸消化酶的用量和反应时长、延伸反应中酶的用量优化、优化延伸引物的用量、延伸终止混合液用量的优化、延伸反应 循环数的优化、脱盐树脂用量的优化、样品点样体积的优化、 10 激光脉冲次数的优化、样本类型、样本采集、保存及运输、 核酸模板用量初步研究、质控体系的建立、实验结果的判定 标准研究。
通过功能性实验,最终确定了最佳的反应体系。开发人根据试剂盒中试剂及组件的主要生产工艺的研究结果,确定 了最佳的生产工艺。
6、二十项遗传性耳聋基因突变检测试剂盒 (飞行时间质谱法)的分析性能评估
本产品分析性能包括准确性、精密度、重复性、分析 特异性、抗干扰以及核酸提取试剂的性能评估。
6.1 准确性研究
阴阳性参考品符合率评估中,分别使用三个批次的试剂盒对企业阴/阳性参考品在适用机型上进行检测,检测结果为阳性符合率 100%、阴性符合率 100%。
6.2.精密度
在运行间、日间、人员间、仪器间和批间精密度符合 率评估中,开发人在适用机型上使用连续生产的三批试剂盒对外周血样本(已涵盖不同基因的不同突变类型)进行检测,检测结果的分子量的 ANOVA 方差分析的显著性 P 均大于 0.05 且均为相应型别,符合率均为 100%。 重复性评估中,开发人在适用机型上使用连续生产的三批试剂盒对稀释到检测限浓度的 3 份重复性参考品进行 重复检测 10 次,检测结果表明重复性和批间差均满足技术要求规定的性能指标要求。 临床样本精密度评估中,开发人在适用机型上使用连续生产的三批试剂盒对外周血进行重复检测 3 次,三个批 次试剂盒对样本进行重复三次的检测结果均为相应型别, 结果符合率 100%。 最低检出限浓度水平的精密度评估中,开发人在适用 机型 DR MassARRAY 上使用连续生产的三批试剂盒对稀释 至最低检测限浓度水平的外周血进行重复检测 3 次,三个批次试剂盒对样本进行重复三次的检测结果均为相应型别,结果符合率 100%。
6.3 分析特异性
开发人使用试剂盒对分别加入了不同梯度潜在干扰物质(胆红素、甘油三酯、血红蛋白、链霉素和阿米卡星) 的外周全血(原浓度及稀释至最低检测限浓度水平浓度) 提取的 DNA 在适配机型上进行检测。结果显示当样本中胆 红素浓度≤0.32mg/mL、甘油三酯体积比≤5%、血红蛋白浓 12 度≤18mg/mL 和链霉素浓度≤15g/mL 和阿米卡星浓度 ≤15μg/mL 的范围内时,均不干扰本试剂盒的检测结果,且不影响试剂盒对最低 DNA 浓度(2.5ng/µL)样本的检测结 。
在靶突变最低检出限浓度水平样本的干扰研究评估 中,开发人使用连续生产的三批试剂盒对稀释至最低检测 限浓度水平的含不同潜在干扰物质(胆红素、甘油三酯、 血红蛋白、链霉素和阿米卡星)的样本进行重复检测 3 次,本试剂盒可以准确地检测出样本的相应类型,说明外 周全血样本胆红素浓度≤0.32mg/mL、甘油三酯体积比 ≤5%、血红蛋白浓度≤18mg/mL、链霉素浓度≤15g/mL 和阿米卡星≤15μg/mL 范围内时,不影响试剂盒对最低 DNA 浓 度(2.5ng/µL)样本的检测结果。
GJB3 基因突变样本的干扰评估中,开发人使用试剂盒 对分别加入了不同梯度潜在干扰物质(胆红素、甘油三 酯、血红蛋白、链霉素和阿米卡星)的干扰样本(检测试 剂盒范围内 2 例 GJB3 耳聋基因突变阳性外周全血样本) 在适配机型 DR MassARRAY 上进行检测。结果显示当样本 中胆红素浓度≤0.32mg/mL、甘油三酯体积比≤5%、血红蛋白浓度≤18mg/mL 和链霉素浓度≤15g/mL 和阿米卡星浓度 13 ≤15μg/mL 的范围内时,对该试剂盒 GJB3:538C>T 突变 杂合体和 GJB3:547G>A 突变杂合体检测不造成干扰。
6.4 最低检出限
最低检测限评估中,开发人设置了 3 个浓度梯度的人 基因组 DNA,并对每个浓度的 DNA 样本进行重复检测 10 次,将具有 100%检出率的最低浓度设定为检测限。 在检测限测定评估中,开发人使用连续生产的三批试 剂盒对稀释至最低检测限浓度水平的 23 份检测限参考品进行检测,检测结果显示检测限参考品符合率为 100%。 两种样本类型检测限评估中,开发人使用连续生产的 三批试剂盒对稀释至最低检测限浓度水平的外周血(包含 试剂盒检测范围外突变样本和其他遗传性疾病样本)进行检测,检测结果显示均为相应型别,结果符合率为 100%。
6.5 提取试剂盒性能研究
针对核酸提取试剂性能研究,开发人采用临床样本平行比较了不同厂家核酸提取或纯化试剂的提取性能,通过对 比提取所得 DNA 的浓度和检测结果,最终确定广州市达瑞 14 生物技术股份有限公司的核酸提取或纯化试剂可以为该产 品的配套提取试剂。
6.6.其他性能研究
6.6.1 环境污染产生的可能性研究
为了验证试剂盒对环境产生污染的可能性,开发人在 扩增室的五点处放置装有高压灭菌纯化水的培养皿,在第三天将所有培养皿中的水用提取试剂进行核酸提取,并使用连续生产的三批试剂盒进行检测,实验研究表明本试剂盒不会造成环境污染。
6.6.2 相邻峰检测结果的研究
相邻峰检测结果验证评估中,开发人使用连续生产的三批试剂盒对 GJB2:235delC 及 SLC26A4:IVS7-2A>G 突 变复合杂合体样本和 SLC26A4:IVS7-2A>G 野生型样本进 行检测,检测结果发现对于峰位较近的位点,一个峰较高 时对临近峰的结果判定是没有影响的。
6.6.3 不同靶板(芯片)孔间交叉污染研究
不同靶板(芯片)孔间交叉污染评估中,开发人在一 个阴性质控周围设置了阳性质控,并使用连续生产的三批 15 试剂盒进行检测,检测结果显示均为相应型别,不同靶板 (芯片)孔间不会造成检测结果交叉污染。
7、二十项遗传性耳聋基因突变检测试剂盒 (飞行时间质谱法)的阳性判断值的确定
对于 20 个突变位点(GJB2 上的 35 del G、176_191 del16、 235 del C、299_300 del AT、167delT,GJB3 上的 538C>T、 547G>A,SLC26A4 上的 IVS7-2A>G、2168A>G、281C>T、 589G>A、1174A>T、1226G>A、1229C>T、IVS15+5G>A、 1975G>C、2027T>A、2162C>T,和线粒体 12S rRNA 上的 m.1555A>G、m.1494C>T),开发人使用受试者工作特征曲线(receiver operating characteristic curve,简称 ROC 曲线) 通过已知检测结果的临床样本确定阳性判断值。当 20 个位 点的野生型及突变型中至少一个峰的峰高≥2 时,SNR≥3 时, 则认为结果可靠,可进行下一步判定:根据突变型峰值∕野生 型峰值进行判定,如果峰高比>3 则判定为纯合突变(野生 型峰值为 0 时,其峰高比接近无穷大,也符合该判定),如果 0.5≤峰高比≤3,则判读为杂合突变,其他情况(也就是如 果<0.5),则判读为野生型。
为验证阳性判断值,开发人使用试剂盒对已知检测结果的临床样本进行检测。检测结果表明建立的阳性判断值能准确判断检测范围内的 20 个突变位点的突变状态。
8、二十项遗传性耳聋基因突变检测试剂盒 (飞行时间质谱法)的稳定性研究
开发人对本产品的实时稳定性、开瓶稳定性、冻融稳 定性、运输稳定性以及样本稳定性进行了研究,确定了在 各种条件下本产品及样本的有效保存时间。
研究结果表明:检测试剂盒储存于-20±5℃;芯片试剂 盒储存于室温 15~30℃;本试剂盒在以上所述储存条件下的有效期为 9 个月。
本试剂盒允许开瓶 12 次,开瓶 12 次后可以保存 8 个 月;反复冻融次数不超过 12 次,反复冻融 12 次后可保存 6 个月;在储存温度下,运输时间不应超过 10 天。
样本稳定性研究表明,EDTA 抗凝管采集的外周全血样本置于 2~8℃保存时可以保存 60 天,在-20±5℃保存时可以 保存 6 年,冻融次数不超过 4 次。外周全血提取的 DNA 样 本置于-20±5℃可以保存 6 个月。

来源:嘉峪检测网


