您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-12-12 12:32
视黄醇结合蛋白测定试剂盒(免疫比浊法)是指利用免疫比浊法(如免疫透射比浊法、胶乳增强免疫比浊法等)对人血清、血浆或尿液的视黄醇结合蛋白(Retinol-Binding Protein,下文简称“RBP”)进行体外定量测定的试剂盒。
一、视黄醇结合蛋白测定试剂盒(免疫比浊法)的研究要求
1.主要原材料研究
1.1主要包括主要原材料的选择、制备、质量标准及实验验证研究,如抗体、胶乳颗粒等;质控品(如包含)、校准品(如包含)的原料选择、制备、定值过程及试验信息;校准品的溯源性文件,包括具体溯源链、试验方法、数据及统计分析等详细信息。
应明确试剂盒所用抗体的名称及生物学来源,若抗体为自制,应输出刺激免疫原名称及来源(天然或重组)等信息,以及抗体制备、筛选、纯化以及鉴定等详细试验信息。还应明确该抗体质量标准的要求(如外观、纯度、蛋白浓度、效价等)及确定依据;若抗体为外购,则应明确抗体的名称及生物学来源、外购方名称,输出外购方出具的抗体性能指标及检验证书和该抗体技术指标。
1.2其他辅助原材料的选择及验证,如反应缓冲液等,应明确每一主要原辅料性能指标的要求以及确定该原辅料作为主要原辅料的依据。若为外购,应输出每一主要原辅料的外购方名称以及外购方出具的每一主要原辅料性能指标及检验证书。
1.3企业内部参考品、校准品、质控品的原料选择、制备、定值过程、质量标准及实验验证研究;具体要求可参考国家标准GB/T 21415《体外诊断医疗器械 生物样品中量的测量 校准品和控制物质赋值的计量学溯源性》及行业标准YY/T 1662《生化分析仪用质控物》、YY/T 1549《生化分析仪用校准物》、YY/T 1709《体外诊断试剂用校准物测量不确定度评定》。
2.主要生产工艺及反应体系的研究
2.1主要生产工艺介绍,可以用流程图方式表示,并标明关键控制点,简要说明主要生产工艺的确定依据,如各组分制备的工艺、试剂的配方及工艺关键参数的确定等。开发者应采用经过验证、能够保证试剂盒质量的生产工艺。
2.2反应原理介绍;
2.3检测方法的介绍:含样本采集、校准方法和质控方法、测试步骤、结果计算等;
2.4反应体系研究:含样本采集及处理、样本要求(抗凝剂的选择(如涉及)、样本稳定性包括样本储存条件、储存时间等)、样本和试剂的用量、反应条件(波长、温度、时间等)、校准方法、质控方法等的研究;
2.5不同适用机型的反应条件如果有差异应分别详述。
2.6不同样本类型的反应条件如有差异应分别详述。
3.性能评估研究
性能评估应至少包括试剂空白吸光度、分析灵敏度、准确度、线性、精密度、分析特异性及其他影响检测的因素等。
3.1试剂空白吸光度
用指定的空白样本重复测定,次数不少于2次,记录试剂盒参数规定读数点主波长下的吸光度值(A),结果均值应符合试剂盒技术要求性能指标的要求。
注:空白样本可以是纯化水、生理盐水、零校准液等。
3.2分析灵敏度
可参照CLSI EP17-A对空白限(LoB)、检出限(LoD)、定量限(LoQ)进行研究。
空白限的建立可使用检测零浓度校准品或样本稀释液的方法进行。例如重复测定20次,根据测量结果的平均值(M)和标准差(SD),计算M+2SD及其对应的浓度值。
检出限的确立可采用系列稀释参考品的方法进行。一般使用有证参考物质进行梯度稀释并进行至少60次检测,95%以上的检测结果高于空白限作为检出限。另外,应使用最低检出限或接近最低检出限水平的样本进行检出限的验证。
定量限应考虑总误差(偏倚和精密度)的要求。偏倚可通过检测已知浓度的低水平样本进行估计,例如检测低水平的有证参考物质。如涉及将样本稀释至低浓度水平,应确保稀释液不引起基质效应,且在低浓度区间呈线性。精密度的估计可根据检测试剂及其应用确定其影响因素,一般应至少包括重复性和日间精密度。
LoB,LoD,LoQ的研究需选择多个样本(空白样本、低浓度水平样本、已知浓度的低水平样本),在多天内进行研究。
3.3准确度
对测量准确度的评价依次包括:与参考物质的相对偏差、方法学比对等方法,开发者可根据实际情况选择以下方法的一项或两项进行研究。优先采用与参考物质的比对研究。
3.3.1相对偏差
测试可用于评价常规方法的有证参考物质3次,测试结果记为(Xi),按YY/T 1584中的相对偏差计算公式分别计算相对偏差(Bi),如果3次结果都不超过±15%,即判为合格。如果大于等于2次的结果不符合,即判为不合格。如果有1次结果不符合,则应重新连续测试20次,并分别按照公式(1)计算相对偏差(Bi),如果大于或等于19次测试的结果都不超过±15%,即判为合格。
3.3.2比对试验
用不少于40个在测定浓度范围内不同浓度的人源样品,采用参考测量程序或国内/国际普遍认为质量较好的已上市同类试剂作为比较测量程序,每份样品按待测试剂盒操作方法及比对方法分别检测。用线性回归方法计算两组结果的相关系数(r)及各浓度点(包括医学决定水平处)的相对偏差或绝对偏差,结果应符合以下要求:
3.3.2.1 RBP试剂盒采用的样本浓度至少覆盖(10.0,120.0)mg/L区间;相关系数r≥0.975;(10.0,30.0]mg/L的区间内,绝对偏差应在±3.0mg/L范围内;(30.0,120.0)mg/L的区间内,相对偏差应在±10.0%范围内。
3.3.2.2 URBP试剂盒采用的样本浓度至少覆盖(0.2,10.0)mg/L区间;相关系数r≥0.975;(0.2,1.0]mg/L的区间内,绝对偏差应在±0.15mg/L范围内;(1.0,10.0)mg/L的区间内,相对偏差应在±15.0%范围内。
注:若样本不稳定,一份样本宜在两个系统同时进行测定。待测系统及参考系统需可比,且满足各自质量标准或试剂盒技术要求后,方可进行比对试验。
3.4线性
建立试剂线性范围所用的样本基质应尽可能与临床实际检测的样本相似,理想的样本为分析物浓度接近预期测定上限的混合样本,且应充分考虑多倍稀释对样本基质的影响。建立一种定量测定方法的线性范围时,需在预期测定范围内选择7—11个浓度水平,每个浓度水平重复测定2—4次。例如将预期测定范围加宽至130%,在此范围内选择更多的浓度水平,然后依据实验结果逐渐减少数据点直至表现出线性关系,可发现最宽的线性范围。
用接近线性范围上限的高浓度样本和接近线性范围下限的低浓度样本,混合成至少5个稀释浓度(Xi)。用所用试剂分别测试以上样本,每个稀释浓度测试3次,分别求出每个稀释浓度检测结果的均值(Yi)。以稀释浓度(Xi)为自变量,以测定结果均值(Yi)为因变量求出线性回归方程。计算线性回归的相关系数(r),结果应符合以下要求:
3.4.1 RBP试剂盒
开发者应该明确RBP试剂盒,线性至少覆盖(10.0,120.0)mg/L区间:
a)线性相关系数r应不小于0.990;
b)(10.0,30.0]mg/L的区间内,绝对偏差应在±3.0mg/L范围内;(30.0,120.0)mg/L的区间内,相对偏差应在±10.0%范围内。
3.4.2 URBP试剂盒
开发者应该明确URBP试剂盒,线性至少覆盖(0.2,10.0)mg/L区间:
a)线性相关系数r应不小于0.990;
b)(0.2,1.0]mg/L的区间内,绝对偏差应在±0.15mg/L范围内;(1.0,10.0)mg/L的区间内,相对偏差应在±15.0%范围内。
3.5精密度
精密度的评价包括重复性、中间精密度和再现性内容,评价时充分考虑影响精密度的条件:如操作者、测量仪器、测量程序、试剂批次(lot)、校准(校准品批次,校准周期)、运行(run)、时间、地点、环境条件(实验室温度、湿度、空气质量、管理等)等。精密度研究中应至少进行重复性、日间精密度和批间差的研究。精密度研究用样本一般为临床实际检测样本或其混合物,必要时可进行稀释、添加或采用基质合理的质控品。样本浓度一般包括测量区间高、中、低在内的3~5个水平,应有医学决定水平或参考区间上、下限浓度附近的样本。精密度研究可能涉及多天、多地点检测,应确保样本的稳定性和一致性,可将样本等分保存。
3.5.1重复性
在重复性条件下,用试剂盒测试不同浓度的样本,重复测试10次,计算10次测试结果的平均值( )和标准差(S),根据YY/T 1584中的重复性计算公式得出变异系数(CV),结果均应符合变异系数(CV)不大于10%的要求。
)和标准差(S),根据YY/T 1584中的重复性计算公式得出变异系数(CV),结果均应符合变异系数(CV)不大于10%的要求。
3.5.2批间差
用3个不同批号的试剂盒分别测试不同浓度的样本,每个批号重复测试3次,分别计算每批3次测试的均值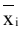 (i=1,2,3)根据YY/T 1584中的批间差计算公式计算相对极差(R),不同浓度样本测试结果均应符合批间相对极差(R)不大于15%的要求。
(i=1,2,3)根据YY/T 1584中的批间差计算公式计算相对极差(R),不同浓度样本测试结果均应符合批间相对极差(R)不大于15%的要求。
3.5.3日间精密度
在室内质控在控情况下,依据 CLSI EP5-A2文件对RBP试剂盒的日间精密度进行评价。要求由同一(组)操作员在同一环境条件中,使用同一仪器,同一方法和同一批号试剂,对同一测试样本(通常采用校准品)每天重复测试2次,取均值记为(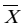 i),记录20天的测试结果,根据式(1)、(2)计算日间精密度变异系数(CV),结果应符合日间精密度变异系数(CV)不大于10%的要求。
i),记录20天的测试结果,根据式(1)、(2)计算日间精密度变异系数(CV),结果应符合日间精密度变异系数(CV)不大于10%的要求。
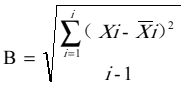 ................................(1)
................................(1)
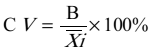 ...................................(2)
...................................(2)
式中:
B—日间变异估计值;
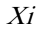 —第i天的测试结果均值;
—第i天的测试结果均值;
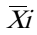 —i天内测试结果的总均值;
—i天内测试结果的总均值;
CV—日间变异系数。
3.6分析特异性
3.6.1交叉反应
对易产生交叉反应的其他抗原、抗体等进行验证,如前白蛋白、视黄醇等,交叉反应验证物质的浓度应涵盖人体生理及病理状态下及临床治疗过程中可能出现的最高浓度值,可采用纯品物质分别添加到健康人样本、参考区间附近样本中的方式进行验证。
3.6.2干扰物质
应针对不同样本类型,分别评价可能存在的干扰情况,干扰物质浓度的分布需覆盖人体生理及病理状态下可能出现的物质浓度,如无法获得含有高浓度干扰物质的样本,可采用纯品物质分别添加到健康人样本、医学决定水平或参考区间上、下限附近样本的方式进行验证,说明样本的制备方法及干扰实验的评价标准,确定可接受的干扰物质浓度。一般采用至少两个分析物水平的样本进行评价,可为临近医学决定水平或参考区间上下限以及病理水平。
开发者应描述清楚抗原是否是天然抗原或重组抗原,若为天然抗原,应对前白蛋白及视黄醇是否干扰检测进行验证,一般不采用重组抗原进行干扰性研究。
3.6.2.1血清或血浆中的干扰物质
应评价血清或血浆样本中常见干扰物质对检测结果的影响,如甘油三酯、胆红素(游离、结合)、血红蛋白、类风湿因子、抗核抗体、人抗鼠抗体(Human Antimouse Antibody,HAMA)、其他疾病相关蛋白及患者体内的异常生化代谢物等干扰因子的研究(结果应量化表示,禁用轻度、严重的模糊表述)。
3.6.2.2尿液中的干扰物质
尿液样本中常见干扰物质对检测结果的影响,如白蛋白、尿素、亚硝酸盐、pH值的研究(结果应量化表示,禁用轻度、严重的模糊表述)。
3.6.3药物影响(如适用)
常见相关治疗药物对检测结果的影响。
3.6.4抗凝剂的影响
如果试剂盒适用样本类型包括血浆样本,应研究抗凝剂对检测结果的影响。如乙二胺四乙酸盐、肝素、枸橼酸盐等,结果应量化表示。应采用各种适用抗凝剂抗凝的血浆样本分别与血清样本进行对比实验研究。方法为对比线性范围内的同一个体的血清和血浆样本,应包含参考区间上下限附近样本进行检测以验证所用试剂对于血清和血浆样本检测结果的一致性。样本量选择应体现一定的统计学意义,说明样本的制备方法及干扰实验的评价标准,确定可接受的干扰物质极限浓度。
3.7校准品溯源、质控品定值以及性能验证(如有)
应进行校准品详细的赋值溯源,包括赋值试验报告和溯源性文件等;质控品应进行详细的定值研究。
校准品、质控品的量值溯源报告的要求,可参照GB/T 21415《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》进行详述。应输出企业(工作)校准品及试剂盒配套校准品赋值及不确定度计算程序与记录,给予质控品定值及其靶值范围确定报告。
相关标准
校准品的研究应按照YY/T 1549 《生化分析仪用校准物》的要求进行性能验证。
质控品的研究应按照YY/T 1662 《生化分析仪用质控物》的要求进行性能验证。
如试剂盒中不包括校准品,应说明所适配校准品的制造商和批号,同时输出相应的溯源信息。
3.8钩状(Hook)效应(如有)
说明不会产生Hook效应的浓度上限及相关研究,一般需在试剂盒说明书上明示对钩状效应的研究结果。
研究过程应注意基质效应影响,必要时应进行基质效应的研究。
3.9最大可稀释倍数(如有)
如需稀释,应注明对稀释液的要求、最佳或最大稀释比例,并明确相关的验证信息。
3.10其他需注意问题
对于适用多个机型的试剂盒,应进行试剂盒说明书【适用机型】项中所列的所有型号仪器的性能评估研究。
若包含不同的包装规格,需对不同包装规格之间的差异进行分析或验证。如不同的包装规格试剂盒间存在性能差异,需要对采用每个包装规格试剂盒进行上述项目评估试验信息及总结。如不同包装规格之间不存在性能差异,需要对包装规格之间不存在性能差异进行详细说明,具体说明不同包装规格之间的差别及可能产生的影响。
4.稳定性研究
稳定性研究主要涉及以下几部分内容,所用试剂的稳定性研究、适用样本的稳定性研究。
试剂稳定性:主要包括实时稳定性、运输稳定性、复溶稳定性(如适用)、开瓶稳定性(包括机载稳定性)、冻融次数限制(如适用)等。对于实时稳定性研究,应给予至少3批次试剂盒在实际储存条件下保存至成品有效期后的研究,并应当充分考虑试剂盒在储存、运输和使用过程中的不利条件,进行相应的稳定性研究。研究信息包括研究方法的确定依据、研究目的、实施方案、评价标准、研究数据和研究结论等。
样本的稳定性:室温保存、冷藏或冷冻条件下的有效期验证,复溶要求验证,适用冷冻保存的样本应对冻融次数进行研究评价。
如试剂盒包含校准品和质控品,可参考YY/T 1549《生化分析仪用校准物》、YY/T 1662《生化分析仪用质控物》标准要求,进行相应稳定性研究。
试剂(含校准品和质控品)稳定性、样本稳定性的研究结果均应在说明书【储存条件及有效期】和【样本要求】两项中进行详细说明。
二、视黄醇结合蛋白测定试剂盒(免疫比浊法)的风险分析
风险分析应符合YY/T 0316《医疗器械风险管理对医疗器械的应用》的要求。
风险分析应包含但不仅限于以下方面的内容:预期用途错误包括:设计开始时未设定预期分析物、未作适用机型验证、未针对特定的样本类型验证。性能特征失效包括:精密度失效、准确度失效、非特异性、稳定性失效、测量范围失效、定量失效、量值溯源失效、校准失效。不正确的结果包括:配方错误、采购的原料未能达到设计要求的性能、原材料储存条件不正确、使用了过期的原材料、反应体系不正确、试剂与包装材料不相容。可能的使用错误包括:生产者未按照生产流程操作,检验者未按照原料、半成品、成品检验标准操作,装配过程组份、标签、说明书等漏装或误装,成品储存或运输不当,客户未参照试剂盒说明书设置参数或使用。与安全性有关的特征包括:有毒化学试剂的化学污染、样本的潜在生物污染、不可回收包装或塑料的环境污染。
三、视黄醇结合蛋白测定试剂盒(免疫比浊法)的相关标准
GB/T 21415体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性
GB/T 26124临床化学体外诊断试剂(盒)
YY/T 1584视黄醇结合蛋白测定试剂盒(免疫比浊法)
YY/T 1584《视黄醇结合蛋白测定试剂盒(免疫比浊法)》
参考YY/T 1549《生化分析仪用校准物》
质控品参考YY/T 1662《生化分析仪用质控物》

来源:嘉峪检测网


