面对生产低风险医疗器械的制造商普遍关心的问题,MDSAP认证是可以豁免的么?新版MDSAP审计方法为大家带来了答案。
2022年MDSAP AUDIT APPROACH 迎来了更新版本,其中一个显著变化是,新增了附录6,澄清了MDSAP五国的监管机构允许的豁免政策。
"审核组织不得将任何过程、产品或服务排除在审核范围或证书范围之外,除非认可的监管机构所管理的法规允许排除"。这一要求被用来证明参加MDSAP的组织必须接受认证范围的审核,包括所有医疗器械分销的司法管辖区,以及在这些司法管辖区分销的所有医疗设备。
有资格被排除在MDSAP计划之外的活动/过程、产品或设备首次在MDSAP AUDIT APPROACH中以附件的方式列出。
请注意:
● 一个设备只有在符合所有适用于审计的管辖区的相应排除标准时,才能被排除在MDSAP的审计范围之外。
● 一个辖区只有在没有任何医疗设备在该辖区销售的情况下才可以被排除,或者在该辖区销售的所有医疗设备都可以被排除。
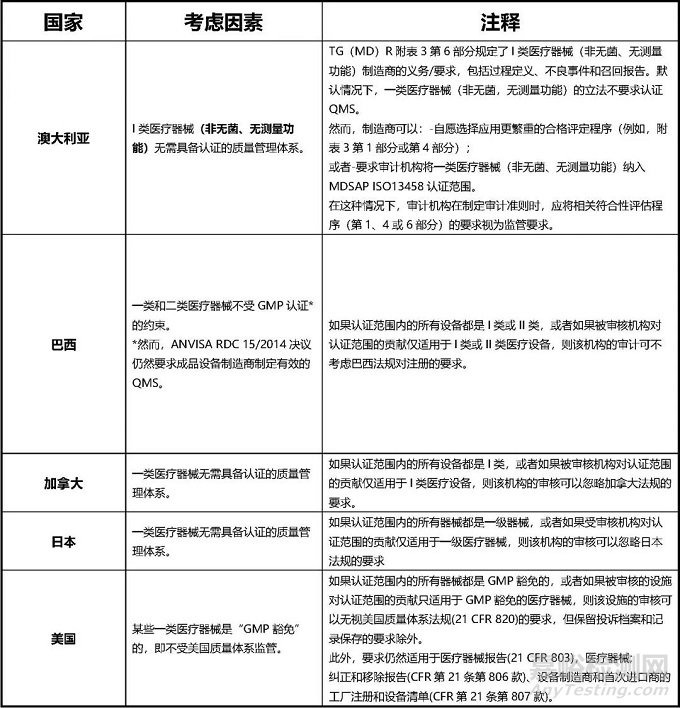
从上我们可以看到,并非所有的一类医疗器械制造商可以豁免在质量体系认证之外,比如澳大利亚对一类灭菌和一类带测量功能的设备是不能豁免的;巴西虽然对一类医疗器械制造商豁免体系认证,但仍要求成品制造商制定有效的质量管理体系。
美国的要求中明确指明了仅GMP豁免的一类器械才可以。
从如下FDA官网中我们可以查询510(k)豁免清单和GMP的要求:
Medical Device Exemptions 510(k) and GMP Requirements (fda.gov)
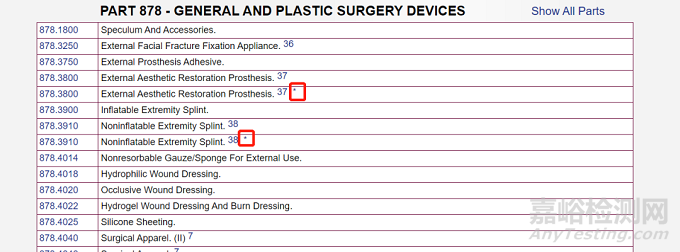
在网页上我们可以看到重要提醒:只有带星号(*)的I类器械也被豁免于GMP法规。
而从下面的截图我们可以看到只有极少数产品标注了*号。这就是说美国可以豁免GMP的器械其实是很少的。