您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-09-30 11:16
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.乐普PD-1抑制剂获批治疗黑色素瘤。乐普生物PD-1抑制剂普特利单抗注射液的第二项适应症获国家药监局批准,用于既往接受全身系统治疗失败的不可切除或转移性黑色素瘤。在关键性Ⅱ期临床中,普特利单抗经IRC评估的客观缓解率为20.2%(95%CI:13.4-28.5,1例完全缓解,23例部分缓解)。今年7月,该新药首次在中国获批,用于微卫星高度不稳定型(MSI-H)或错配修复缺陷型(dMMR)晚期实体瘤适应症。
2.烨辉引进CD74 -ADC启动临床。烨辉医药从Sutro Biopharma公司引进的CD74 ADC药物BN301首次登记启动一项I/II期临床,评估用于晚期B细胞非霍奇金淋巴瘤患者的安全性和有效性(登记号:CTR20222409)。BN301是一种具有靶点创新性和位点特异性的抗体偶联药物(ADC),每个ADC分子由一个人源的非糖基化抗CD74 IgG1 抗体和两个不可裂解的美登素药物-连接子组成。在美国,BN301/STRO-001已被FDA授予治疗多发性骨髓瘤的孤儿药资格。
3.BI新型PDE4B抑制剂在华获批IPF临床。勃林格殷格翰BI 1015550片的IND申请获国家药监局批准,拟开发适应症为特发性肺纤维化(IPF)。BI 1015550片是一款新型PDE4B抑制剂,目前处于Ⅲ期临床开发阶段。发表在《新英格兰医学杂志》上一项Ⅱ期临床结果显示,BI 1015550延缓了患者的肺功能下降率,优于安慰剂的概率超过98%。今年2月,FDA已授予BI 1015550用于IPF的突破性疗法认定。
4.百吉EBV靶向T细胞疗法报鼻咽癌IND。百吉生物1类生物制品BRG01注射液的临床试验申请获CDE受理(CXSL2200487)。BRG01是一款通过基因修饰技术将靶向EB病毒(EBV)抗原的受体表达于T细胞表面而制备成的自体T细胞免疫治疗产品,拟用于治疗复发/转移性鼻咽癌。2020年全球确诊的鼻咽癌新发病例数达到13.3万人,中国鼻咽癌新发病例约占全球的50%。
5.科望CD39/TGF-β双抗报IND。科望医药治疗用1类生物制品注射用ES014的临床试验申请获CDE受理,拟用于晚期实体瘤的治疗。ES014是一款能同时靶向CD39和TGF-β的双功能分子,通过将TGF-βII型受体胞外结构域融合到靶向CD39的抗体上设计而成,具有免疫抑制去除和免疫功能激活的强力协同作用。临床前研究显示,ES014在PD-1无反应小鼠模型中展现出较强的单药抗肿瘤疗效。
6.先声药业自免新药海外授权。先声药业宣布与Almirall S.A签订独家授权协议,将临床前期拟用于自身免疫疾病的候选药物IL-2突变融合蛋白(IL-2 mu-Fc)SIM0278在大中华以外地区开发和商业化所有适应症的独家权利授予Almirall S.A公司。根据协议,先声药业将获得Almirall支付的1500万美元首付款,可能高达4.92亿美元开发和商业里程碑潜在付款,以及产品的销售分成。据悉,该项协议总金额已创下国内同类临床前项目对海外授权最高纪录。
国际药讯
1.首款眼表麻醉剂获FDA批准上市。Harrow与Sintetica联合开发的凝胶滴眼液IHEEZO(3%的盐酸氯普鲁卡因眼用凝胶)获FDA批准上市,是近14年来FDA批准上市的首款眼部麻醉剂,无需注射给药,用于眼表麻醉。一项Ⅲ期临床结果显示,IHEEZO起效时间约1-1.5分钟,平均持续时间达到22分钟,能为手术过程提供足够的麻醉时间。该新药受FDA专利保护有效期至2038年。
2.盐野义新冠口服药III期临床成功。盐野义3CL蛋白抑制剂Ensitrelvir Fumaric Acid (S-217622)在亚洲用于轻度/中度COVID-19患者在症状出现后72小时内服用治疗的II/III期临床结果积极。最新Ⅲ期研究结果显示,与安慰剂相比,接受低剂量ensitrelvir(在日本提交批准的剂量水平)治疗的患者首次缓解五种COVID-19症状的中位时间显著缩短(167.9vs192.2小时,p=0.04)。今年6月,基于II期数据提交的ensitrelvir紧急授权申请被日本PMDA暂缓批准。
3.嗜睡症新药IIa期临床达主要研究终点。NLS Pharmaceutics公司开发的Quilience(Mazindol ER)在治疗嗜睡症的IIa期临床NLS-1021达到主要研究终点。与安慰剂相比,Quilience(3mg)显著改善患者白天嗜睡症状,两组在第4周时患者白天过度睡眠(EDS)较基线平均减少7.1分和3.2分(p=0.0081);在所有时间点,Quilience在减少患者猝倒发作的疗效均优于安慰剂。Quilience总体耐受性良好,未发现安全问题,无严重不良事件报道。
4.舌下给药肾上腺素临床数据积极。Aquestive公司肾上腺素舌下膜剂AQST-109用于过敏反应的EPIPHAST II试验结果积极。结果显示,单剂量的AQST-109达到最大血浆药物浓度的中位时间(Tmax)的平均时间显著更快,为12分钟,而肾上腺素自动注射器达和普通肌内注射到Tmax的平均时间分别为22.5分钟和45分钟。QST-109重复给药的血药浓度显著更高,给药后的Tmax仅需8分钟。此外,AQST-109与肾上腺素自动注射器给药后的收缩压和心率的变化相似。
5.罕见免疫缺陷病PI3Kδ抑制剂获FDA优先审查。FDA受理Pharming Group公司口服选择性PI3Kδ抑制剂leniolisib的新药申请(NDA)并授予其优先审查资格,用于治疗12岁及以上青少年和成人PI3Kδ过度活化综合征(APDS)。PDUFA日期为明年3月29日。在一项II/III期研究中,与安慰剂组相比,leniolisib治疗组患者的淋巴结病变指数较基线有统计学意义上的降低(p=0.006),且免疫功能正常化。
6.γ-分泌酶抑制剂获FDA快速通道认定。Ayala公司γ-分泌酶抑制剂AL102(BMS-986115)获FDA授予快速通道资格,用于治疗进展性硬纤维瘤。γ-分泌酶是激活Notch通路的关键蛋白酶;而Notch通路对细胞增殖、存活、迁移、侵袭、耐药性和转移扩散等过程具有关键的促进作用,而这些过程与癌症预后较差相关。目前暂无疗法获批用于治疗不可切除、复发性或进行性硬纤维瘤。
医药热点
1.江西省人民医院成立罕见病诊治中心。为积极响应国家罕见病防治政策,改善江西省罕见病患者的就诊现状,江西省人民医院(南昌医学院第一附属医院)日前宣布成立罕见病诊治中心,中心将开设罕见病多学科联合门诊,将通过集中患者、集约专家、集纳科研平台等方式开展罕见病诊治。
2.葛均波院士基础科学中心正式获批。近日,2022年国家自然科学基金集中接收申请项目评审结果公布。复旦大学3项国家自然科学基金基础科学中心项目正式获批。其中,交叉科学部“泛血管介入复杂系统”基础科学中心项目由葛均波院士领衔,复旦大学为依托单位,复旦大学附属中山医院具体承担。项目以“生物-材料-力学相互应答”理论为指引,以研发更先进的“生物友好型”介入材料、介入技术及策略为目标,推动生物材料、生物力学和医疗器械相关学科群及产业群融合发展,有望大力提升我国在泛血管介入领域原始创新能力和研发水平,带动我国泛血管介入医学及产业跨越式发展。
3.第十二届药典委员会成立。9月27日,第十二届药典委员会成立暨第一次全体委员大会在京召开,部署2025年版《中国药典》编制工作任务。第十二届药典委员会由454名委员组成,设执行委员会和29个专业委员会,国家药监局局长焦红任主任委员,国家卫健委副主任曾益新、国家中医药局副局长王志勇、国家药监局副局长赵军宁、国家药监局副局长黄果任副主任委员。2025年版《中国药典》编制工作全面启动。
评审动态
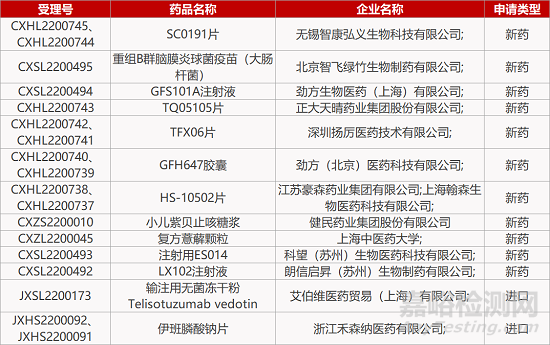
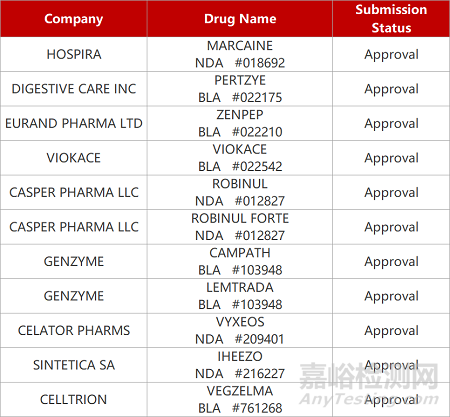
1. CDE新药受理情况(09月29)

来源:药研发


