您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-09-21 14:17
医疗器械包装货架有效期一旦超过,就意味着该器械产品在使用中具有潜在风险,可能不再满足性能指标和发挥预期用途。因此,医疗器械货架有效期非常重要,近年来无菌医疗器械包装广泛使用,但是,用了无菌医疗器械包装就可以保证无菌医疗器械在使用前一直处于安全无菌的状态吗?
其实不然,医疗器械包装所使用材料的物理性能以及粘贴剂可能会随着时间的推移而发生降解,从而导致其在贮存和运输过程中发生动态事件,这一系列问题最终会破坏包装系统的完整性,导致系统内的医疗器械产品受到污染。
来看看相关的政策要求:
2021年国家药品监督管理局医疗器械技术审评中心发布了《无源植入性医疗器械货架有效期注册申报资料指导原则 (2021年修订版)》(征求意见稿)意见的通知,指导原则中明确指出无源非植入性医疗器械有关货架有效期注册申报时的相关测试要求。
该指导原则第三部分“货架有效期验证”内容中提到,医疗器械货架有效期的验证试验通常可包括加速稳定性试验、实时稳定性试验等。鉴于医疗器械产品更新换代速度较快,采用加速稳定性试验可加快产品的上市需求。加速稳定性试验设计是建立在假设材料变质所涉及的化学反应遵循阿列纽斯(Arrhenius)反应速率函数基础上的,具体可参考标准YY/T 0681.1和ASTM F1980。而有些医疗器械不适用于采用加速稳定性验证的,需要进行实时稳定性验证。
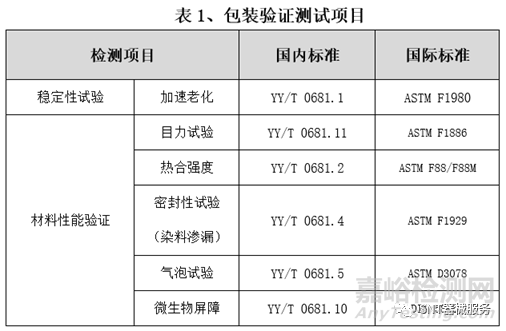
无论加速稳定性试验还是实时稳定性试验,针对于产品自身及包装系统均要进行相应的测试项目。测试项目是评估产品随时间老化的相关性能,就包装系统性能测试而言,可采用包装完整性测试,包括包装封口完整性、包装强度和微生物屏障性能等测试项目。
其中,包装完整性测试项目包括染色液穿透法测定透气包装的密封泄漏试验、目力测试和气泡法测定软性包装泄漏试验等;包装强度测试项目包括软性屏障材料密封强度试验、无约束包装抗内压破坏试验和模拟运输试验等。另外,指导原则建议注册申请人在试验过程中设立多个测试观察时间点(一般不少于3个)测试。
因此,推荐企业在做医疗器械包装验证时,相关检测项目可参考以下表格。
总之,无菌医疗器械包装是保障无菌医疗器械产品安全有效的重要组成部分。通过上述物理检测以及最终包装件的模拟运输试验,以保证医疗器械产品的安全性和有效性。
医疗器械货架有效期是以医疗器械以终产品形式储存,能够发挥拟定作用的时间段。医疗器械包装货架有效期的终点是产品失效日期,超过此期限后,就意味着该器械可能不再满足已知的性能指标,不能发挥预期功能。因此,为更好地保障医疗器械的合规性,本文参照最新政策,整理了医疗器械货架有效期验证的要点,供大家参考。
附:医疗器械包装货架寿命验证24个常见问题汇总
Q1、如果双层包装材质一样,仅是尺寸不同,也需要对两种包装分别确认吗?可以仅确认尺寸大的包装袋工艺参数,以此说明小袋子也是适用相同参数吗?
A:在对包装材料特性、灭菌过程等影响因素进行充分评估后,可以只确认尺寸大的包装袋工艺参数。但是从严谨和减小风险的角度,在有条件的情况下,建议两种尺寸的包装都进行确认,因为有一层包装直接和产品接触,在运输和存放过程中,这一层包装可能与产品产生最直接力的作用,对密封区和包装材料都有一些挑战。
Q2、根据DIN 58953的微生物屏障试验(湿法)中血琼脂平板采用的是什么培养基呢?
A:血琼脂是营养琼脂冷却至45℃左右与10%的去纤维蛋白质绵羊血混合。也可购买血琼脂平板成品直接使用。
Q3、根据DIN58953的微生物屏障试验(湿法)中使用的菌种一定要是金黄色葡萄球菌吗?
A:是的,标准YY/T0681.14和DIN58953-6中有规定试验菌种为ATCC6538。
Q:4、根据DIN58953的微生物屏障试验(湿法)中样片需要灭菌吗?
A:需要,不灭菌容易出现假阳性。
Q5、根据DIN58953的微生物屏障试验(湿法)中,将滴加菌液后的样片干燥16小时,是在生物安全柜里面干燥吗?
A:是的。将生物安全柜内部温度保持在标准要求的范围,并对温度进行监控,让滴加菌液后的样片在生物安全柜里面干燥规定的时间。这样可以避免污染烘箱和外部环境。
Q6、根据DIN58953的微生物屏障试验(湿法)中样品采用什么灭菌方式?
A:可以采用钴-60辐照、高压蒸汽或紫外辐照,考虑到钴-60辐照和高压蒸汽灭菌会对材料产生一定破坏,所以建议使用紫外辐照。但要注意紫外辐照只能对物体表面灭菌,所以样品要铺开,正反都要灭菌。灭菌之前要对辐照时间和辐照强度进行验证。
Q7、无源医疗器械做注册是否一定要进行模拟运输试验?
A:需要。
Q8、产品储存温度为(0~40)℃,那么环境温度可以选25℃吗?还是选择产品储存最高温度40℃?
A:选择产品储存最高温度40℃。对于标记了特定长期存储温度范围的产品,建议将计算AA持续时间所用的TRT与该温度范围的上限一样。TRT选择的温度更高,将产生更长的、更保守的加速老化持续时间,并且对于创建验证与一系列存储温度条件兼容性的加速老化数据非常有用。
Q9、加速老化方案采用高温高湿可以吗?预定成品有效期2年,做加速老化3年后的包装确认测试可以吗?
A:加速老化的温湿度条件需要根据无菌屏障系统或器械所使用的材料及其相关降解机制来确定,确保选择适当的相对湿度水平,以避免非自然的材料变化。考虑到真实世界环境变化的复杂性,建议设定长于预期申报货架有效期的观察点。
Q10、请问特卫强纸适用真空泄漏测试吗?
A:适用。
Q11、货架寿命与模拟运输需要结合在一起吗?
A:是的。货架寿命验证需要评估产品随时间老化的相关性能,包括产品自身性能测试和包装系统性能测试两方面。包装完整性测试包括包装封口完整性、包装强度和微生物屏障性能等测试项目。其中,包装强度测试项目包括模拟运输试验等。
Q12、请问FDA要求的模拟运输测试可以用ISTA标准做吗?ASTM D4169也可以做吧?
A:可以,但是建议使用ASTM D4169。
Q13、请问如果储存温度为0-30度,上下限温度条件下的试验都要进行吗?
A:在做加速老化试验时,对于标记了特定长期存储温度范围的产品,建议将计算AA持续时间所用的TRT与该温度范围的上限一样。TRT选择的温度更高,将产生更长的、更保守的加速老化持续时间,并且对于创建验证与一系列存储温度条件兼容性的加速老化数据非常有用。在做实时老化试验时,建议上下限温度条件下的试验都要进行。
Q14、老化和模拟运输可以用同一个样品吗?
A:可以用同一个样品。需要注意的是医疗器械货架有效期验证试验适宜测试项目(如包装密封性)可采用无产品的包装进行验证,而模拟运输试验样品要求有代表性的完整的运输单元样本组成,包括实际内装物。
Q15、从包装、灭菌、老化以及模拟运输是否需要用同一批产品做一个连续的验证?这样才算完整的一个验证吗?
A:是的。货架有效期验证试验宜采用与常规生产相同的终产品进行。
Q16、对于产品的性能也要做老化后的测试吗?
A:是的。货架寿命验证需要评估产品随时间老化的相关性能,包括产品自身性能测试和包装系统性能测试两方面。
Q17、可以用空包装进行测试吗?
A:适宜测试项目(如包装密封性)可采用空包装进行验证。
Q18、模拟运输测试一般要测几箱?
A:1箱。
Q19、在包装确认试验中,做了产品无菌试验还要做包装材料的微生物屏障试验吗?
A:如适用,可采用包装完整性测试用于替代无菌测试。无菌是从微生物角度验证包装完整性,阻菌测试只是包装完整性测试中的一项。
Q20、目视检查包装外观非匀态或欠封区是否一定要在紫外灯下观察,还是在日光灯下观察即可?
A:日光灯下观察即可,但是要记录光的照度。
Q21、模拟运输中集中冲击试验都是要做的吗?可以选做吗?
A:不是都要做。根据产品从生产到消费的特定路线中预期发生的危险因素,确定流通周期,不同的流通周期对应不同的试验进程。
Q22、样品加速老化后需要先做模拟运输后做包装确认测试吗?
A:不一定。根据样品实际储存运输情况,可选择老化前或老化后对用于稳定性研究的终产品进行模拟运输处理。
Q23、实时老化样品可以和加速的不是同一批吗?
A:需要是同一批。
Q24、如果产品贮存条件是相对湿度不超过80%,无腐蚀性气体,干燥,通风良好,清洁的室内。针对这个条件,那我们选择老化试验的温度和湿度如何选择?
A:加速老化的温湿度条件需要根据无菌屏障系统或器械所使用的材料及其相关降解机制来确定,确保选择适当的相对湿度水平,以避免非自然的材料变化。建议根据贮存条件下的最高温度和最高相对湿度以及设定的加速老化温度来确定加速老化时的相对湿度。

来源:Internet


