您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-09-16 11:19
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
上海泉生干细胞疗法获批烧伤临床。泉生生物1类生物制品“人脐带间充质干细胞注射液”获CDE临床许可,拟针对“Ⅱ度烧伤”开展临床试验。干细胞在烧伤伤口和全身抗炎作用方面具有宏观和微观改善的潜力。根据Market Research和Transparency Market Research研究显示,2020年干细胞全球市场预计超过1700亿美元;其中北美是全球最大的干细胞市场,西欧和亚太的市场占比分别为38%和17%。
国内药讯
1.泽璟杰克替尼治疗AS的II期临床成功。泽璟生物自主研发的新型JAK抑制剂盐酸杰克替尼片用于治疗活动性强直性脊柱炎(AS)的II期临床(ZGJAK008)结果积极。与安慰剂相比,盐酸杰克替尼片(100 mg Bid、75 mg Bid)在治疗16周时显著提高达到ASAS20应答的患者比例(62.9%和59.4%,vs33.3%)。泽璟生物计划与CDE沟通交流(pre-III期沟通交流)后开展关键注册临床试验。
2.北京浦润奥c-MET靶向药拟纳入优先审评。北京浦润奥生物申报的1类新药伯瑞替尼肠溶胶囊(bozitinib)获CDE拟纳入优先审评,针对的适应症为“c-MET外显子14突变的局部晚期或转移性非小细胞肺癌(NSCLC)”。bozitinib是一款小分子高选择性MET激酶抑制剂,能够透过血脑屏障,阻断ZM融合基因下游信号通路,达到抑制肿瘤生长和侵袭的作用。此前,CDE已将其纳入突破性治疗品种。
3.宜明昂科CD70单抗启动临床。宜明昂科自主研发的CD70单抗IMM40H首次在国内登记启动一项I期临床试验,拟评估用于治疗晚期实体肿瘤和复发或难治性恶性血液系统肿瘤的安全性和有效性。该项试验主要研究者由复旦大学附属肿瘤医院张剑博士和季冬梅博士共同担任。这是宜明昂科中美同步开发的第三个新药项目,8月底,该新药获得FDA临床许可。
4.信诺维新型抗菌药国内获批Ⅲ期临床。信诺维医药β-内酰胺酶抑制剂XNW4107获国家药监局批准开展Ⅲ期临床,与亚胺培南/西司他丁钠联用治疗革兰阴性菌引起的医院获得性细菌性肺炎(HABP)和呼吸机相关性细菌性肺炎(VABP)。在美国,FDA已授予XNW4107合格传染病产品资格和快速通道资格,并在今年4月批准XNW4107开展Ⅲ期临床。信诺维计划近期启动XNW4107的全球多中心关键Ⅲ期临床研究。
5.皮下注射PD-L1单抗获FDA快速通道资格。思路迪医药与康宁杰瑞联合开发的PD-L1单抗恩沃利单抗注射液获FDA授予快速通道资格,针对软组织肉瘤适应症。值得一提的是,该新药用于软组织肉瘤适应症曾获得FDA的孤儿药资格认定。恩沃利单抗皮下注射可30秒内完成用药,为静脉不耐受的肿瘤患者需求提供解决方案。目前该新药在中国、美国和日本针对多个瘤种同步临床开发,多个适应症已进入注册/Ⅲ期临床。
国际药讯
1.安进KRAS抑制剂肺癌Ⅲ期临床积极。安进在EMSO年会上公布全球首款KRAS G12C抑制剂Lumakras(Sotorasib,AMG510)治疗KRAS p.G12C突变的非小细胞肺癌(NSCLC)经治患者的III期临床(CodeBreaK 200)最新结果。与多西他赛(静脉输注)相比,Lumakras口服治疗显著提高患者的无进展生存期(PFS),两组中位PFS分别为5.6个月和4.5个月(HR:0.66,95% CI:0.51-0.86);1年期无进展生存率分别为24.8%和10.1%;ORR分别为28%和13%(P<0.001)。两组之间的OS没有显著的统计学差异。
2.阿柏西普长效给药III期临床成功。拜耳/再生元联合宣布,阿柏西普(8mg)12周一次和16周给药一次治疗新生血管(湿润)年龄相关性黄斑变性(nAMD)和糖尿病性黄斑水肿(DME)患者的两项国际关键III期研究(PHOTON和PULSAR)达到主要终点。每16周给药一次治疗,分别有77%的nAMD患者和89%的DME患者能够维持16周的注射间隔(第一年平均注射5次);每12周给药一次治疗,分别有79%的nAMD患者和91%的DME患者能够维持12周的注射间隔(第一年平均注射6次)。阿柏西普(8mg)的安全性与Eylea的既定安全性一致。
3.辉瑞mRNA流感疫苗上Ⅲ期临床。辉瑞与BioNTech联合开发的四价修饰RNA(modRNA)流感疫苗Ⅲ期临床首位病患给药。该疫苗是根据WHO所建议在2022-23年北半球预测流行病毒株来制作。在Ⅱ期临床中,65岁以上成人接种7日后,疫苗可引起较一般流感疫苗大于2倍的CD4+与CD8+ T细胞免疫反应;疫苗具有良好的安全性与免疫原性。辉瑞预计在美国入组2.5万18岁以上的成人开展这项Ⅲ期试验。
4.FIC免疫调节剂再获FDA快速通道资格。aTyr Pharma公司FIC免疫调节剂efzofitimod获FDA授予用于治疗系统性硬化(SSc,也称为硬皮病)相关间质性肺疾病(ILD)快速通道资格认定。efzofitimod是一种融合蛋白,由组氨酰-tRNA合成酶的免疫调节结构域与人源化抗体的Fc区融合而成,它可在活动性炎症期间靶向先天和适应性免疫细胞,通过选择性调节NRP2恢复免疫平衡。此前,FDA曾授予efzofitimod治疗肺结节病的快速通道资格认定。
5.眼科基因治疗公司完成B轮融资。SparingVision公司宣布完成7500万欧元的B轮融资,以协助推动公司两项不受突变类型限制,用以治疗视网膜色素变性(Retinitis Pigmentosa)的基因疗法(SPVN06和SPVN20)进入人体临床试验。SPVN06是一种通过单一视网膜下注射,递送表达RdCVF与RdCVFL神经营养因子至视网膜色素上皮层的疗法。SPVN20则主要被设计用以治疗携带休眠视锥细胞的晚/末期视网膜色素变性患者。SPVN20可递送通道蛋白至休眠的视锥细胞中,以达到恢复细胞内光传导级联反应的目的,与最终视力与色彩视觉的恢复。
6.基因工程微生物药物公司完成新一轮融资。Novome Biotechnologies宣布完成4350万美元的B轮融资,主要用于推进其高草酸尿症候选药物NOV-001的Ⅱa期临床和多种用于治疗炎症性肠病(IBD)的基因工程微生物候选药物(GEMMs)的开发。NOV-001是一种由重组活生物治疗产品NB1000S和NB2000P(一种植物来源的多糖)组成的在研组合,已在Ⅰ期临床中显示出良好的安全性和耐受性,能够安全地定植到人类肠道,并通过每日一次的益生元控制分子来控制其在肠道内的丰度。
医药热点
1.重庆江津尝试人才“区聘镇用”。近日,重庆市江津区首批“区聘镇用”人员上岗,区级医院下派的27名医务人员分赴朱杨镇卫生院、中山镇卫生院等23家基层医疗机构,开展为期1年的基层医疗服务工作。此次选派的医务人员均是临床医学专业,其中有17名有研究生学历。据悉,为保障“区聘镇用”人员的工资待遇,该区财政每年将投入300万元,同时区级医疗机构自筹资金,建立“区聘镇用”专用资金池。
2.江苏拟建约10所省级研究型医院。江苏省卫健委日前印发《江苏省“十四五”卫生健康科教能力提升工程实施方案》提出,力争到2025年,建设10所左右省级研究型医院、30个左右省级医学创新中心、50个左右省级医学重点学科(实验室)。省级研究型医院要在国家级卫生健康科技创新平台上有新突破;牵头开展国家级重点研发项目、重大科技专项和新药、医疗器械临床研究,建立具有国际领先水平的医学新技术、疾病诊疗指南、行业标准等标志性成果。
3.至少1700万欧洲人被新冠后遗症困扰。根据世卫组织欧洲区域办事处13日公布的估计数字,至少1700万欧洲人在2020年和2021年遭遇新冠后遗症困扰。报道介绍,疲劳、咳嗽、呼吸短促、间歇性发烧、失去味觉或嗅觉、抑郁等等,新冠后遗症表现为一长串症状中的一个或多个症状,通常在感染后三个月内出现症状,且症状持续至少两个月。世卫组织呼吁对患者进行更好的护理。
评审动态
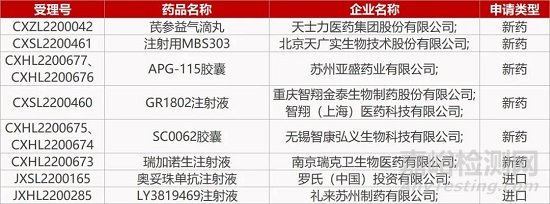
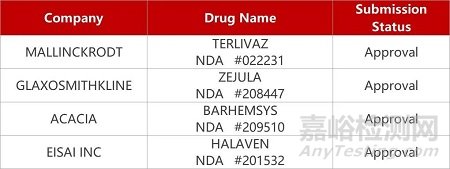

来源:药研发


