您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-07-01 11:44
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.艾力斯「伏美替尼」获批治疗NSCLC。艾力斯医药抗肿瘤新药甲磺酸伏美替尼(艾弗沙)新适应症获NMPA批准,用于一线治疗表皮生长因子受体(EGFR)外显子19缺失突变或外显子21置换突变的局部晚期或转移性非小细胞肺癌(NSCLC)。甲磺酸伏美替尼是艾力斯医药自主研发的第三代EGFR-TKI创新药,该公司去年6月已与ArriVent 公司达成伏美替尼的海外独家授权合作协议,合作金额超8亿美元。
2.金赛生长激素新适应症获批。金赛药业重组人生长激素注射液的新适应症获国家药监局批准,用于治疗儿童生长缓慢、儿童身材矮小、生长障碍等多种适应症。生长激素(GH)是由人体脑垂体前叶分泌的一种肽类激素,能促进骨骼、内脏和全身生长。该新药已在国内获批多项适应症,包括性腺发育不全(特纳综合征)所致女孩生长障碍、因内源性生长激素缺乏所引起的儿童生长缓慢、重度烧伤治疗等。
3.科兴脊灰灭活疫苗通过WHO预认证。科兴开发的Sabin株脊髓灰质炎灭活疫苗(sIPV)日前已通过世卫组织预认证(PQ),被列入世卫组织采购清单,可供联合国系统采购。该疫苗是科兴去年7月在国内刚获得国家药监局注册批件的新疫苗,也是科兴继甲型肝炎灭活疫苗孩尔来福(成人、儿童)之后,第三款获得PQ认证的疫苗产品。今年3月,国药集团中国北京生物制品研究所开发的Sabin株(Vero细胞)脊髓灰质炎灭活疫苗(sIPV)也通过WHO预认证。
4.科伦TROP-2-ADC拟纳入突破性治疗品种。科伦药业旗下科伦博泰开发的TROP-2-ADC新药SKB264获CDE拟纳入突破性治疗品种,针对的适应症为局部晚期或转移性三阴性乳腺癌。科伦博泰拥有SKB264的自主知识产权,正在中美两国同步进行SKB264针对多个瘤种的临床开发。在中国,同靶点药物已有8家申报;云顶新耀引进的Trodelvy、科伦药业的SKB264均处于Ⅲ期临床阶段。
5.华昊中天改良型抗肿瘤新药报IND。北京华昊中天提交的2.2新药优替德隆胶囊的临床申请(IND)获CDE受理。优替德隆是一种埃博霉素类似物,其抗肿瘤作用机理与紫杉醇相似,具备广谱抗肿瘤活性,对多药耐药的实体瘤依然有效。华昊中天开发的优替德隆注射液已于2021年3月获批上市,是首个且唯一境内企业自主开发的微管抑制剂1类创新药。
国际药讯
1.艾伯维JAK抑制剂用于nr-axSpA获CHMP支持。欧洲药品管理局人用医药产品委员会(CHMP)推荐批准艾伯维口服抗炎药JAK1抑制剂Rinvoq(瑞福®,upadacitinib,乌帕替尼)用于治疗对非甾体抗炎药应答不足、有客观炎症体征的活动性放射学阴性中轴型脊柱关节炎(nr-axSpA)。在一项Ⅲ期临床(SELECT-AXIS 2 nr-axSpA)中,与安慰剂组相比,Rinvoq治疗组达到ASAS40应答的患者比例显著更高(45%vs23%;p<0.0001)。
2.GSK带状疱疹疫苗在日本申请扩大使用范围。葛兰素史克宣布,已向日本厚生劳动省(MHLW)提交重组带状疱疹疫苗Shingrix用于在18岁及以上免疫功能低下的成人中预防带状疱疹。Shingrix是一种非活重组亚单位佐剂疫苗,分2剂肌肉注射。该产品此前已获批在日本上市,用于50岁及以上成年人预防带状疱疹。在中国,Shingrix(欣安立适)于2020年6月获得批准,是国内首个上市的重组带状疱疹疫苗。
3.FIC银屑病新药Ⅲ期临床结果积极。Can-Fite公司潜在“first-in-class”A3AR激动剂piclidenoson治疗中重度银屑病的Ⅲ期临床COMFORT达到主要研究终点指标。与安慰剂组相比,piclidenoson(3mg)治疗组16周时达PASI75应答的患者比例更高(9.7%vs2.6%,P<0.04)。32周时,该新药与对照药物相比,在PASI 75(17%vs26.2%)与PASI 50( 34.1%vs49.5%)上呈现劣效性,但在银屑病失能指数上展现优效性(20.5%vs10.3%,P<0.05)。piclidenoson的安全性与安慰剂类似,与活性对照药物相比更优。
4.益普生石头人症新药获优先审评资格。FDA受理益普生(Ipsen)选择性RARγ激动剂palovarotene的新药申请(NDA)并授予其优先审评资格,拟用于治疗进行性肌肉骨化症(FOP,也称为“石人综合征”)的罕见遗传疾病。在一项Ⅲ期临床MOVE中,与未经治疗患者相比,palovarotene组患者的异位骨化比率下降了62%。目前palovarotene已获批加拿大上市,商品名为Sohonos。
5.儿童肝脏疾病创新疗法真实世界数据积极。Mirum公司公布回肠胆汁酸转运体抑制剂Livmarli(maralixibat)治疗1岁及以上Alagille综合征(ALGS)患者的胆汁淤积性瘙痒症的临床研究的6年随访结果。数据显示,maralixibat治疗后患者6年无事件生存率显著提高:P值<0.0001(HR:0.305,95% CI:0.189-0.491),无移植生存率在统计学上出现显著改善:P值<0.0001(HR:0.332,95% CI:0.197-0.559);分别有76%和79%接受maralixibat治疗的ALGS患者保持无事件和无移植生存状况。此外,maralixibat治疗使ALGS患儿的瘙痒状况得到显著、持久的改善。
6.司美格鲁肽治疗NASH未达II期主要终点。诺和诺德在EASL2022年会上公布司美格鲁肽(semaglutide)治疗非酒精性脂肪性肝炎(NASH)的II期临床(NCT03987451)结果。48周治疗数据显示,司美格鲁肽治疗组肝纤维化得到改善同时NASH没有恶化的患者比例只有10.6%,而安慰剂组这一数值为29.2%。司美格鲁肽治疗组患者NASH出现消退的比例为34%,而安慰剂组为20.8%。目前司美格鲁肽用于NASH适应症的开发仍在进行当中。去年4月,该公司启动司美格鲁肽治疗NASH的国际III期临床。
医药热点
1.2022年国家医保目录调整工作启动。《2022年国家基本医疗保险、工伤保险和生育保险药品目录调整工作方案》及相关文件日前正式公布,启动新一轮国家医保药品目录调整工作。本轮医保药品目录调整完善了准入方式,非独家药品准入时同步确定支付标准。该准入方式借鉴谈判原理,由专家测算确定医保支付意愿,然后企业自主报价,只要有一家企业参与且报价低于医保支付意愿,该通用名就可纳入目录,并以最低报价作为该通用名的支付标准。
2.北京修订院前院内急救衔接制度。北京市卫健委发布《北京市院前与院内医疗急救衔接工作管理办法(2022年版)》。对比2019版的办法,本次发布的《办法》在服务对象、机构及职责、监督管理等方面均作出调整。其中,新版《办法》将“三无”人员定义由“无身份、无家属、无经济来源的人员”调整为“无劳动能力、无法定赡养人或者法定扶养人不具有扶养能力、无生活来源的人员”。
3.两部门发布氯巴占临时进口方案。为进一步完善药品供应保障政策,满足人民群众对于氯巴占等国外已上市、国内无供应的少量特定临床急需药品需求,国家卫健委和国家药监局日前联合印发《临床急需药品临时进口工作方案》和《氯巴占临时进口工作方案》,发布了牵头进口和使用氯巴占的50家医疗机构名单。
评审动态
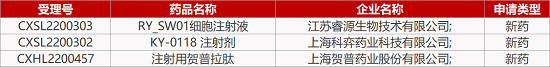
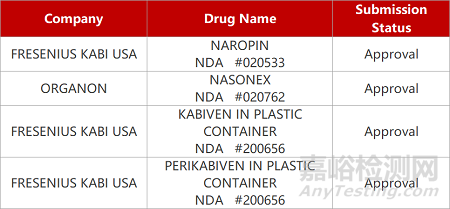

来源:药研发


