您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-06-27 10:56
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
5.嘉和携手艾博开发肿瘤mRNA药物。嘉和生物与艾博生物达成合作开发协议,双方将基于嘉和生物抗体开发平台,并结合艾博生物旗下自主创新的mRNA制剂研发及大规模生产的平台,合作进行肿瘤治疗的mRNA药物的探索研究。嘉和生物拥有早期发现全球首创/全球最佳、差异化、免疫肿瘤双/多特异性抗体研发平台,目前已有数个FIC/BIC项目启动。此次合作,有望在肿瘤治疗领域带来全新的mRNA治疗药物。
国际药讯
1.罕见遗传性皮肤病首款疗法获批上市。欧盟批准Amryt公司外用植物药产品Filsuvez上市,用于6个月以上营养不良性和交界性大疱性表皮松解症患者的部分厚度伤口(PTW)的治疗。在涉及角质形成细胞分化和迁移的伤口愈合过程中,该药通过桦树三萜对炎症和上皮再生的作用来加速伤口闭合。在Ⅲ期临床中,Filsuvez与对照组相比,显著提高患者的创面愈合率(41.3%vs28.9%,p=0.013),使目标创面愈合可能性增加44%。这是针对这类患者的首款获批疗法。
2.百时美施贵宝CAR-T获批扩展适应症。FDA批准百时美施贵宝(BMS)CD19-CAR-T疗法Breyanzi(lisocabtagene maraleucel)新适应症,用于治疗一线治疗失败后的复发/难治性大B细胞淋巴瘤(LBCL)。在关键Ⅲ期临床中,与标准治疗相比,一次Breyanzi输注显著延长患者的无事件生存期(中位EFS:10.1个月vs2.3个月),将患者的无进展生存期延长2倍以上。此前,该新药已获批用于治疗接受过两种或以上系统治疗的复发/难治性LBCL。
3.乳腺癌口服SERD疗法报NDA。Menarini Group与Radius Health联合开发的选择性雌激素受体降解药物(SERD)elacestrant,已向FDA递交的新药申请(NDA),用于治疗ER+/HER2-晚期或转移性乳腺癌患者,两家公司同时寻求获得优先审评资格。在Ⅲ期临床EMERALD中,与标准治疗相比,elacestrant用于二线或三线单药显著改善总体患者的无进和展生存期(PFS),显著改善ESR1突变患者的PFS。临床中药物的安全性特征与之前研究相似。
4.吉利德HDV新药Ⅲ期临床成功。吉利德首创抗病毒药物Hepcludex(bulevirtide)治疗慢性丁型肝炎病毒(HDV)感染者的Ⅲ期MYR301试验48周治疗数据积极。结果显示,bulevirtide显著降低患者的病毒载量。与没有接受抗病毒治疗的患者相比,bulevirtide(2mg和10mg)治疗组患者达到病毒学和生化联合反应的比例显著更高(45%和48%,vs2%)。药物的安全性与之前报告的一致。Hepcludex已于2020年获得欧盟附条件批准上市,目前正在接受FDA的监管审查。
5.CAR-T+CARVac组合获优先药物资格。欧洲药品管理局授予 BioNTech公司CLDN6-CAR-T与表达CLDN6的CAR-T细胞扩增RNA疫苗(CARVac)构成的组合疗法BNT211优先药物资格,用于三线或后线治疗睾丸生殖细胞肿瘤。在AACR2022年会上公布的Ⅰ/Ⅱ期(NCT04503278;2019-004323-20)临床数据显示,所有6例经预处理的睾丸癌患者均符合临床疗效分析标准且显示出统计优势。1例患者在治疗18周后达到完全缓解,3例患者获得部分缓解。此外,CLDN6-CAR-T治疗或与CARVac联合治疗的耐受性良好。
6.体内CRISPR基因编辑疗法最新数据积极。Intellia公司与再生元联合开发的CRISPR/Cas9基因编辑疗法NTLA-2001,在治疗转甲状腺素蛋白淀粉样变性(ATTR)Ⅰ期临床中期数据积极。NTLA-2001(0.1mg、0.3mg、0.7mg和1.0mg)能剂量依赖性降低血清中的TTR水平;其中0.3mg和1.0mg剂量组患者平均TTR水平降低89%和93%,两组TTR水平降低维持至少达到12个月和6个月;NTLA-2001在所有剂量水平中均显示出良好的耐受性。
医药热点
1.北京世纪坛医院成立肥胖与代谢病中心。6月23日,首都医科大学附属北京世纪坛医院肥胖与代谢病中心正式成立。该中心将采用多学科综合治疗的模式,在内分泌科、营养科、心内科、呼吸科、麻醉科、ICU、妇产科、中医科、心理医学科、整形科、骨科、消化科、康复科等多学科团队的支持下,为肥胖及糖尿病患者提供门诊检查、住院治疗和术后随访等“绿色通道”服务。
2.我国南方部分省份进入流感高发期。国家流感中心日前发布的全国流感监测信息显示,6月南方省份流感病毒检测阳性率持续上升,部分省份进入夏季高发期,以A(H3N2)亚型流感病毒为主。在6月6日—6月12日期间,南方省份哨点医院报告的流感样病例占门诊量百分比为5.8%,高于前一周5.1%水平,也高于2019—2021年同期水平,创了近年来同期新高。疾控专家提醒,接种流感疫苗是预防流感最经济和有效的措施之一。
3.深圳首创“生前预嘱”立法。6月23日,深圳市七届人大常委会第十次会议表决通过了《深圳经济特区医疗条例》修订稿,“生前预嘱”首次被写进条例中。这意味着2023年1月1日条例正式实施后,深圳居民的“生前预嘱”将受法律保护。“生前预嘱”是人们在健康或意识清楚时签署的一份容易填写的表格式文件,主要内容包括“我的五个愿望”。当因伤病或年老无法对自己的医疗问题做决定的时候,这份文件能明确表达签署者的重要医疗意见。
评审动态
2. FDA新药获批情况(北美06月23日)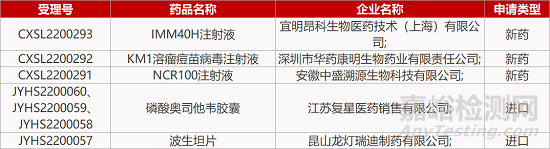
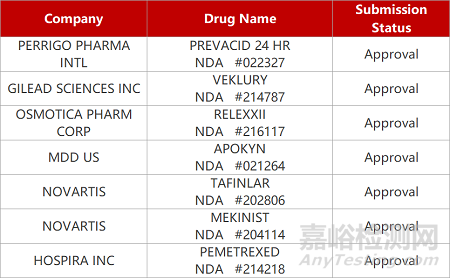

来源:药研发


