您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-06-16 22:49
背景
边缘产品指那些从一开始就不清楚它们是否属于医疗器械或药品的产品。通常来说,同一个产品不可能既属于医疗器械又属于药品,一个产品要么是受医疗器械法规监管,要么是按照药品监管。如按照医疗器械进行监管,产品必须满足医疗器械的定义。医疗器械协调小组在4月份发布了医疗器械和药品界限的指导文件,在此指导文件中对相关术语做了详细的说明并列出几种具有特殊属性的医疗器械和组合产品。接下来,我们来看一下这些要求具体都是什么。
定义
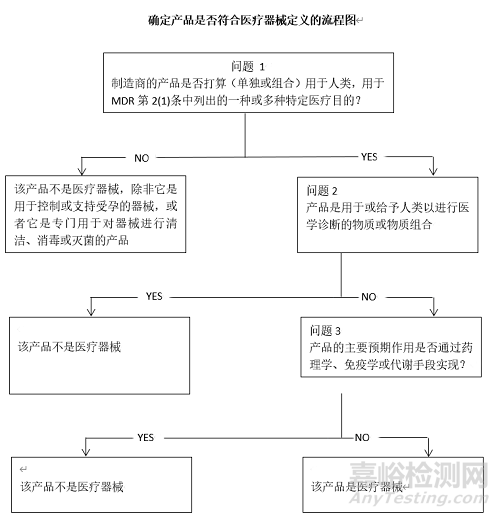
医疗器械:指制造商打算单独或组合用于人类用于以下一种或多种特定医疗目的的任何仪器、设备、器具、软件、植入物、试剂、材料或其他物品:
疾病的诊断、预防、监测、预测、预后、治疗或缓解
对伤害或残疾的诊断、监测、治疗、减轻或补偿
解剖结构或生理或病理过程或状态的调查、替换或修改
通过对人体标本的体外检查提供信息,包括器官、血液和组织捐赠
并且不能通过药理学、免疫学或代谢方式在人体内实现其主要预期作用,但可以通过这些方式辅助其功能。
药品:具有治疗或预防人类疾病特性的任何物质或物质组合或者可用于或给予人类以通过药理学、免疫学或代谢作用恢复、纠正或改变生理功能或进行医学诊断的任何物质或物质组合。该定义包括两个部分,一个与表现有关,另一个与功能有关。如果产品被这些表现中的一个或两个覆盖,则该产品构成药品。
一种物质,如果单独使用,将可能/可以被视为药品:MDR法规并未说明“作为器械组成部分的物质,如果单独使用,将可能被视为药品”,当从器械中释放并作用于人体内或人体上时,将会被认为是药品。由于提到了“如果单独使用”,无论它是否可供人体使用,也无论其在器械中的数量、给药方法或途径如何,该物质可以被认为是一种药品。特别注意的是,根据MDR附录II 6.2(a)的要求,如果单独使用可被视为药品的含药医疗器械的CE技术文件,应当包含为评估物质的安全性、质量和有效性而进行的测试数据。此外,根据MDR附件IX 5.2点(b)的规定,执行符合性评估的公告机构将在根据MDR附件X第6 点的规定颁发CE证书之前验证器械中此类物质部分的有用性。
物质具有辅助器械的作用:物质具有辅助于器械的作用应理解为发生在人体或其成分(例如血液、器官、体内或体外、配子、伤口渗出液)中或人体上,并将支持器械实现其预期的医疗目的。为确定该物质是否具有对器械的辅助作用,应考虑人体或其成分可利用的此物质的量是否会产生作用。根据MDR第7条,如果制造商表明该物质没有任何辅助器械的作用,则不得在 IFU、标签、包装、广告和网站上或通过任何其他方式声称与该物质有关的益处。
如何判定是否为医疗器械
药品定义中提到任何具有治疗或预防人类疾病特性的物质都可以是药品,然而根据MDR法规对医疗器械的定义,医疗器械也可以用于治疗和预防疾病以及其他特定的医疗目的。因此,区分这两个类别的决定性因素是 “作用方式”,根据药品的定义,用于或给予人类以进行医学诊断的物质,即使它们不是通过药理学、免疫学或代谢手段实现其功能,也被视为药品。根据MDR第1(6)(b)条,在决定产品是属于医疗器械还是药品时,应特别考虑产品的主要作用方式。通常,医疗器械的主要预期作用是通过物理方式实现的。
下面决策树旨在帮助确定产品是否符合MDR对医疗器械的定义:
几种特殊属性的医疗器械
基于物质的医疗器械
基于物质的医疗器械是由医疗器械中允许使用的物质组成,并且不能通过药理学、代谢或免疫学手段实现其预期作用。MDR中未对“物质”进行定义。尽管MPD对物质做了定义,但该定义包括那些医疗器械中不允许使用的物质。因此,基于物质的医疗器械所含的物质如果属于MPD定义,还必须满足MDR法规关于医疗器械的要求。
医疗器械中不允许使用的物质包括但不限于:
活的生物材料或活的有机体,包括活的微生物、细菌、真菌或病毒
活的动物组织或细胞或其衍生物
活的人体组织和细胞或其衍生物
根据MDR附件VIII,规则3和21专门适用于基于物质的器械,并非所有基于物质的器械都适用于这两个规则,在这种情况下,它们将是按一般规则分类。
由体外使用的物质或物质混合物组成的医疗器械,在植入或给药前与人体细胞、组织、器官或人体胚胎直接接触(按MDR附件VIII规则3分类)
由旨在通过体孔进入人体或应用于皮肤并被人体吸收或局部分散的物质或物质组合组成的医疗器械(按MDR附件VIII规则21分类)
其他基于物质的器械(这些器械没有特定规则)
此外,还应考虑所有其他规则和要求。例如,如果基于物质的器械包含一种物质,如果单独使用,将被视为药品,并且药品的作用与器械的作用相辅相成,则应咨询主管当局或EMA的意见。
体外使用的医疗器械
即由一种或多种物质的混合物组成的医疗器械,在植入或服用前,在体外直接接触人体细胞、组织、器官或人类胚胎。
MDR附件VIII的规则3是指由拟在体外使用的物质组成的器械。该规则涵盖用于体外处理最终将重新引入体内的体液/组织的医疗器械。它还涵盖用于人类胚胎的基于物质的器械。体外使用的基于物质的器械示例:
用于移植器官的运输的溶剂(不能通过药理学、免疫学或代谢手段实现其主要预期作用)
体外受精媒介
由拟引入人体或应用于皮肤的物质或物质组合组成的医疗器械
由旨在通过身体孔洞进入人体或应用于皮肤并被人体吸收或局部分散的物质或物质组合组成的产品”,并且满足MDR第2(1)条定义的产品是医疗器械。
医疗器械和药品组合产品
在确定产品组合的监管状态时,第一步是确定产品是否为整体产品。第二步应确定器械中包含的药品的作用是作为器械部分的主要作用还是辅助作用。如果整体产品的主要预期作用是由物质实现的,则整个产品作为药品按照指令2001/83/EC或法规(EC)No 726/2004被监管为。但是如果主要预期作用是通过器械实现的,产品按照含药器械进行监管,应符合MDR法规的要求。
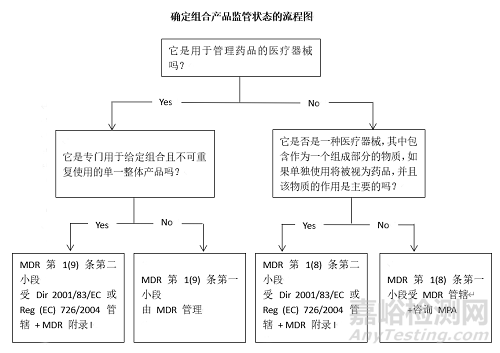
MDR在第1条第8款和第1条第9款中针对与药品一起使用的医疗器械规定了四种监管方案,请参见下面的流程图:
医疗器械和药品的整体组合
医疗器械和药品的整体组合被规定为药品,此类别包括旨在管理药品的器械,并且该器械和药品形成一个单一的整体产品,该产品专门用于给定的组合并且不可重复使用。它还涵盖将药品作为一个组成部分并入其中的器械,其中药品的作用相对于器械的作用是主要的。根据MDR法规,组合产品受指令2001/83/EC或法规(EC) No 726/2004监管,但应符合MDR附录一的通用安全和性能要求。医疗器械和药品整体组合产品可能包括预装药物的注射器,含有药物的气雾剂,预装特定药品的雾化器,用于透皮给药的贴片,含有抗生素的塑料珠,用于治疗骨感染,或将骨诱导蛋白释放到周围骨骼中的基质,宫内避孕药,包含药品的一次性一次性离子电渗疗法设备,含有抗微生物剂的伤口敷料,含有药品的临时根管填充剂,含有嵌入式传感器的药片等。
用于药品给药的医疗器械
此类别涉及旨在管理MPD定义的药品的器械,其中器械和药品不是一体的。在这种情况下,该器械受MDR管辖,但还应符合指令2001/83/EC有关药品的要求。用于药品给药的医疗器械可能包括药物输送泵,植入式输液泵,可重复使用的离子电渗器械,雾化器,注射器、喷射注射器,用于计量吸入器的间隔装置,Port系统。
包含辅助药品且其作为一个组成部分的医疗器械
MDR详细说明了这种医疗器械的情况,其中包含作为一个组成部分对器械起辅助作用,如果单独使用将被视为药品,包括源自人血或人血浆的药品,此类器械应根据MDR进行评估和认证。将人体血液或人体血浆衍生物作为一个组成部分的医疗器械可能包括含有人凝血酶的止血剂/基质和体外受精中使用的含有人白蛋白溶液的培养基。当某些属于药品的草药物质包含在医疗器械中时,按照分类规则14器械将被分为III 类医疗器械。在这种情况下,制造商必须证明该作用是对器械的主要预期作用是辅助性的。被视为药品的草药物质可能包括 丁香油,锦葵,冰岛苔藓/地衣,万寿菊,薰衣草,洋甘菊,贯叶连翘,百里香,茴香等。

来源:海河生物


