您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-04-27 11:28
固态药物为化合物分子堆积形式的一种外化,而固体药物的溶解过程也是打破固态形式,与水溶液完全混合,“水乳交融”的一个过程。下图简单的把溶解的过程分成了三个步骤。首先,固态药物所形成的晶体结构加入的水性介质中,由于分子间的抱团取暖,紧密相互作用,即溶质分子间存在作用力,需要打破分子间作用力,也就是打破晶格能,溶质分子才有可能进入溶剂之中。
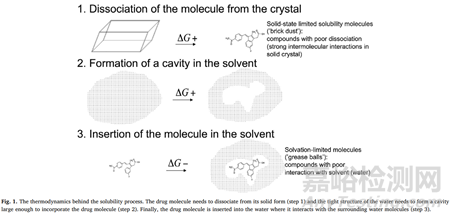
来源于参考文献1
通常,化合物的熔点作为评价其晶格能高低的参数。熔点与晶格能之家的关系不妨这样去理解,一般同一化合物分子由于堆积形式的差异可以形成不同的晶型,不同晶型之间熔点绝对是不同,造成熔点不同的内在因素便是晶格能差异,即分子的在晶体中所处的位置差异造成分子间作用差异,进而造成了晶体体系能量差异。化合物的熔点就和其晶型建立了联系,不同化合物晶型具有不同的熔点,那么就能理解,不同多晶型化合物溶解度的差异。化合物熔点高低的临界点一般认为为200℃,也就是可以这样理解,当一个化合物熔点高于200℃,其晶格能的打破将是溶解度的限制因素。
其实,从上面描述,我们还可以知道,我们在化合物晶型筛选之时,一般选择优势晶型,即化合物性质比较稳定的晶型,是不是也可以推出化合物比较稳定的晶型,一般为分子间作用力比较强的晶型,即晶格能较强,那么,这个化合物的此种晶型的溶解度应为最低溶解度。那么,是不是可以得出,我们所操作的化合物平衡溶解度,应定义为,在一定温度压力下,化合物优势晶型在一定溶剂中的溶解量。
那么,当化合物熔点过高导致溶解度过低,无法满足药物的体内吸收。那么,通过改变晶体结构的晶格能就可以改变化合物的溶解度,如盐型,共晶的筛选,固体分散体的制备。这样就可以很好的解释,当我们粉碎或者微粉化合物粉末,通常仅仅是改变的化合物粉末的粒径及粒径分布,增加了化合物与溶出介质的接触面积,加快了化合物的溶解速率,溶解不发生变化。使用XRD对化合物粉体进行检测,一般要保证化合物晶型不发生变化,也就是及时使用DSC测试熔点,也应该是不发生变化。这样也就解释了粒度与溶解度与溶出之间的关系,化合物通过改变粒度,晶型稳定情况下,溶解度不变,溶出可能因表面积的改变而变化。那么改变粉体形态或者晶癖的道理也是如此,只要化合物的晶型不发生变化,仅仅改变溶出速率,而不会改变溶解度。
当化合物已经打破晶格能,溶质分子成功挣脱了束缚,那么溶剂分子需要留出一个空穴,去迎接化合物分子。空穴的形成一来受化合物分子影响,一般用化合物的分子量来表示,化合物分子量越大,所需要的空穴体积就越大,所需要的空穴能越大。二来受溶剂分子间的作用影响,可以通过添加其他成分来改变溶剂分子的影响,如助溶剂,潜溶剂。
当进入溶解的最后一步,晶体结构的溶质分子已经打破了晶格能,溶剂分子也留出了空穴出来,最后一步考虑,化合物分子与水分子的相互作用力。根据相似相溶原理,水分子是极性最大的分子,化合物分子极性越大,越能与水分子通过离子键、氢键、范德华力等发生作用力,越能提高化合物分子的水化程度,化合物溶解度越高。当然,对于疏水性分子来说,水化能力差,溶解度低,像一个Grease Balls。
化合物水化能力强弱的参数为LogP,即油水分配系数,描述化合物在正辛醇与水之间的分配平衡。因为药物分子结构比较复杂,多同时具有亲水疏水基团,这样化合物分子可能具有两亲性,对于LogP较大的化合物分子,疏水性越强,亲水性越差,LogP较低的药物,反之。下表给出了化合物LogP的范围对于药物溶解度以及体内行为的影响。
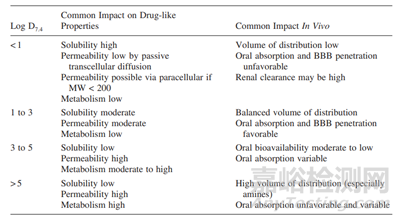
来源于参考文献2
有建议将LogP 2-3作为溶解度的分界点,值越大,水溶性越小。一般认为LogP>5,认为化合物亲脂性极高,极疏水,化合物溶解度可能出现问题。对于此类化合物,采取脂质制剂或许可以解决溶解度问题。当然,因药物化合物多为离子型化合物且药物需要在人体具有pH梯度的胃肠道去经历释放,溶解的过程,那么,化合物的解离情况,将影响其在油水体系中分配,即影响LogP,由此引出了LogD,这个参数,此文不做深入探讨。
从上述化合物的溶解度过程,我们可以清楚的知道化合物的溶解度需要经历的三个过程:打破晶格能-空穴形成-化合物分子水化,一般认为溶解度的第一步和第三步所需要的能量较大,通常作为溶解的限速步骤,同时第一步的影响更加的大。那么,当我们拿到一个化合物分子去执行溶解度测试时,发现化合物溶解度较低,我们需要格外注意以下结论:①粉碎或者微粉不可以提高化合物的溶解度,除非在粉碎或者微粉过程中,化合物出现的物理稳定性的变化,如转晶,无定形化;②改变固体形态或化合物镜下晶癖,也不影响化合物的溶解度,但是可能会对化合物的溶出速率造成影响,也可能会影响化合物的物理稳定性,化学稳定性以及机械性能,如流动性、松密度和可压性等。③化合物处于无定形状态,化合物分子间不具有相互作用,处于长程无序状态,具有高能特性,分子晶格不再是化合物溶解度的限制因素,且化合物粒径处于较小状态,甚至为分子级别,添加亲水性聚合物稳定化合物的无定形形式且保护分子在溶液中保持过饱和状态,同时这也提高了化合物分子的润湿性。对于熔点较高,晶格能限制化合物溶解度的药物分子,无定形固体分散体或许是最好的选择用来增溶的策略。但是,无定形的转晶问题需要深入研究,以保证制备的药物能够在货架期保持稳定性。高能态向低能态转变的趋势无法转变,但是可以能过技术手段,延迟转变的时间。④对于由于化合物分子亲脂性较强,化合物溶解度过程,亲脂性限制化合物溶解,贸然使用固体分散体技术增溶,或许不是最佳手段。通过在处方中添加脂质成分,包裹化合物分子,进而透过胞吞方式提高化合物的生物利用度,或许是最佳手段;⑤化合物的分子量大于500,认为已经过大,其为化合物成药性5规则限制条件之一。据有关报道,化合物的分子量越大,临床试验越是往后失败的机率越大。亦有说法,尽管化合物的成药性多条不符合5规则,也可通过先进高端的制剂手段予以解决,只是难度之大,困难之多,仅此而已。
下面为药物在发现阶段一般溶解度的限定评估:
<10μg/mL low solubility
10-60 μg/mL moderate solubility
>60 μg/mL High solubility
最后,我们回到标题的问题:难溶性药物皆可通过固体分散体增溶?通过前文中对于溶解度的描述,对于这个问题相信大家已经能够有一个比较清晰的认识。面对日益增多的难溶性药物,简单的制剂手段面临着失效的可能,转变思路或许成了我们不得不实现考虑的问题。当然了,工欲善其事必先利其器。制剂人如何掌握住“器”,这样对于制剂人也就提高了要求。
参考文献:
1、Computationalprediction of drug solubility in water-based systems:Qualitative and quantitative approaches used in the current drug discovery and developmentsetting
2、Drug-like Properties: Concepts, Structure Design and Methods -Lipophilicity

来源:药事纵横


