您当前的位置:检测资讯 > 监管召回
嘉峪检测网 2022-02-18 16:28
新型冠状病毒肺炎(COVID-19)是由严重急性呼吸综合征冠状病毒2(SARS-CoV-2,以下简称“新冠病毒”)引起的一种高致病性传染病。在疫情流行的紧急态势下,研制新冠病毒的预防用疫苗(以下简称“新冠疫苗”)是最有效的措施。中国与全球多个国家与地区的研究机构和相关企业相继紧急启动新冠疫苗的研制,仅仅用了一年不到的时间,多款新冠疫苗获批附条件上市或紧急授权使用,我国已累计报告接种新冠疫苗25.7亿剂次。但是,由于人们对新冠病毒的认识尚不充分,加速的疫苗研制进程以及广泛的接种覆盖,也对相应的药品监管提出挑战。本文通过分析我国在新冠疫苗研制和生产方面的监管特点,各个主要环节安全风险,提出加强新冠疫苗监督管理的若干建议。
一新冠疫苗研制取得的初步成果
全球现有超过300款新冠疫苗处在临床研究或上市批准后临床研究中,几乎涵盖了现有疫苗研发的绝大多数技术类型,包括灭活疫苗、病毒载体疫苗、重组蛋白亚单位疫苗、RNA疫苗、DNA疫苗、病毒样颗粒等。表1列举了代表性疫苗及其技术类别和特点、获批情况及所属机构。
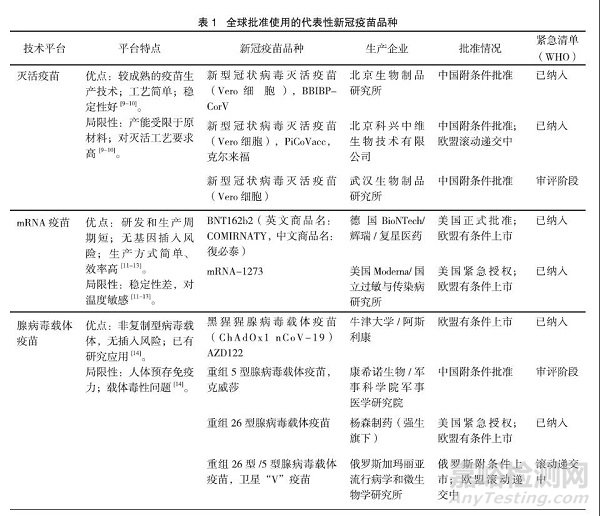
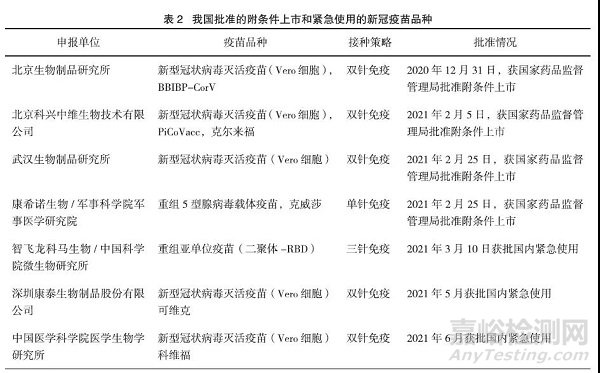
在新冠疫苗研制上市方面,国务院联防联控机制科研攻关组疫苗研发专班火速组建,科研攻关组紧紧抓住灭活疫苗、重组蛋白亚单位疫苗、腺病毒载体疫苗、流感减毒病毒载体疫苗和核酸疫苗5条技术路径,全面推进新冠疫苗的开发。截至目前,我国已有4款新冠疫苗获批附条件上市、3款新冠疫苗获批紧急使用,见表2。
二加快新冠疫苗上市进程的主要监管举措
相对于其他药物,疫苗的研制及评价更加严格,开发周期一般也比较长。为加快新冠疫苗上市进程,我国积极探寻保障新冠疫苗安全有效和开发速度之间的平衡对策。一是优化疫苗注册上市的审评审批程序。我国《中华人民共和国药品管理法》《中华人民共和国疫苗管理法》及配套《药品注册管理办法》(局令第27号)也作出了附条件批准、紧急使用、优先审评审批等规定。二是及时制定新冠疫苗研制的相关指导原则。国家药品监督管理局药品审评中心为加快新冠疫苗的上市进程,组织制定了《新型冠状病毒预防用疫苗研发技术指导原则(试行)》《新型冠状病毒预防用mRNA疫苗药学研究技术指导原则(试行)》《新型冠状病毒预防用疫苗非临床有效性研究与评价技术要点(试行)》等5个指导原则。三是提升新冠疫苗产业建设的政策支持力度。我国高度重视产能建设,专门成立了新冠疫苗的生产保障工作专班,每周对新冠疫苗的产能建设进度进行调度和专人对接,开展“一对一蹲点”式服务,帮助企业解决实际困难。在灭活疫苗建设方面,国家卫生健康委联合相关部门专门制定了新冠疫苗生产车间的生物安全相关的建设和管理要求;同时,通过联防联控机制,协调研发单位利用我国已有的P3实验室,使我国灭活类新冠疫苗的研发具备了基本条件。
三聚焦新冠疫苗上市后监管重点
一是加强疫苗生产生物安全风险管控。利用病原微生物进行疫苗生产,具有一定的生物安全风险,在确保疫苗质量的同时,还应当加强疫苗生产全过程中生物安全的管控。《疫苗生产车间生物安全通用要求》(国卫办科教函[2020]483号)规定了疫苗生产车间的生物安全管理要求。
二是重视新冠疫苗上市后的变更。采用“加速”开发的新冠疫苗,在相对紧迫的时间下进行产业化,可能因多方面原因在生产及质量管理方面发生系列变更。根据《药品上市后变更管理办法》(试行)(公告2021年第8号),省级药监部门对于新冠疫苗上市后许可事项变更、登记事项的变更,以及注册事项变更的备案等承担相应的监管责任。
三是关注新冠疫苗上市后安全性。疫苗主要面向健康人群,其安全性是疫苗开发的底线和首要考量。因此,开展上市后安全监测,新冠疫苗上市许可持有人应当继续开展大范围接种情况下的安全性和临床保护效果跟踪,继续完成Ⅲ期临床试验;对保护持久性继续进行研究;并确保持续稳定地生产符合预设标准的疫苗。按照疫苗的生产原理,不同工艺疫苗的安全性存在一定差异,各个疫苗上市许可持有人还应针对性地对不同平台研制的新冠疫苗开展基于科学评估的风险监管,以及必要的延伸检查。
综上,新冠疫苗的研制,缩短了包括临床试验在内的总体时间,加快了审评审批的速度,但同时也可能伴随疫苗研究数据积累的不足,以及上市后相关配套监管对策滞后等问题。一旦发生疫苗相关的严重不良反应或药害事件,不仅对产品本身的上市使用带来影响,还可能影响疫情防控大局。因此,需要药品监管部门在做好加速推进产品研制申请的同时,持续加大属地药品监管工作的力度,督促企业严格落实主体责任;重点关注企业是否继续完成Ⅲ期临床试验;关注是否继续开展大范围接种情况下的安全性和临床保护效果跟踪,并对保护持久性继续进行研究。(注:文中所有数据引用自发文时)
来源:《中国药事》2022年1月第34卷第1期《我国新冠疫苗研制生产的监管特点分析》作者:刘芬等

来源:Internet


