您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-12-17 15:18
凡是与人体循环血有直接或间接接触的医疗器械,如果没有足够的数据证明其满足血液相容性要求,都要开展血液相容性评价与试验。医疗器械与血液有间接或直接接触的,将与血液中血小板、红细胞、白细胞及血液中血浆蛋白等其他成分发生作用,导致血栓形成、溶血、血浆蛋白粘附等,从而对人体产生有害的影响。
那么到底什么是医疗器械血液相容性评价与试验呢?试验适用的标准是什么?试验选择如何决策?以及试验分类有哪些呢?别急,小编为您细细说来!
01医疗器械血液相容性评价与试验概述
血液相容性评价与试验主要用来评估与血液接触的医疗器械、用于血液或血液制品材料对于人体的影响。在设计评价与试验方案时,需要将产品设计、临床使用、使用环境和风险收益等因素纳入考虑。
按照国家标准GB/T16886.4-2003,血液相容性评价与试验根据被测体系与血液相互作用可分为五类:血栓形成、凝血、血小板和血小板功能、血液学、补体系统。
02医疗器械血液相容性评价与试验的适用标准
国家标准:GB/T16886.4-2003《医疗器械生物学评价第4部分:与血液相互作用试验选择》
国际标准:ISO 10993.4-2017《Biological evaluation of medical devices-Part 4:-Selection of tests for in teractions with blood》
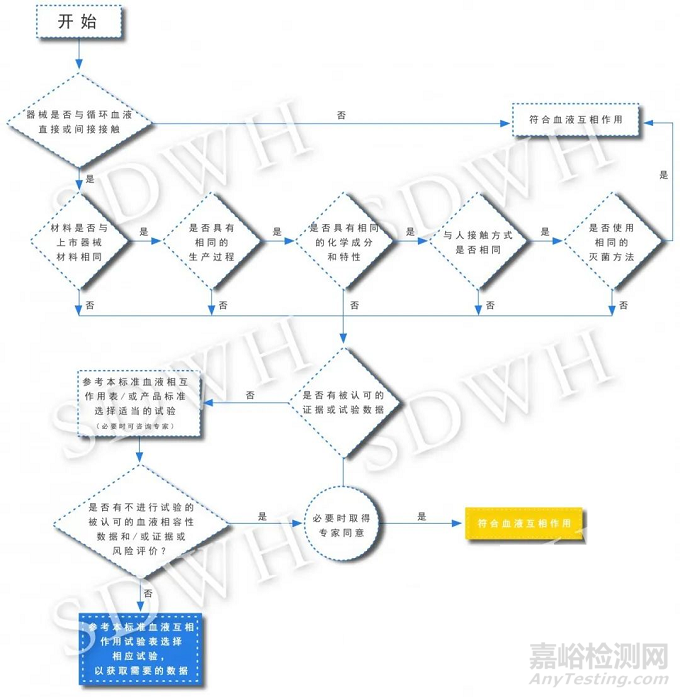
03医疗器械血液相容性试验选择决策流程(GB/T 16886.4-2003)
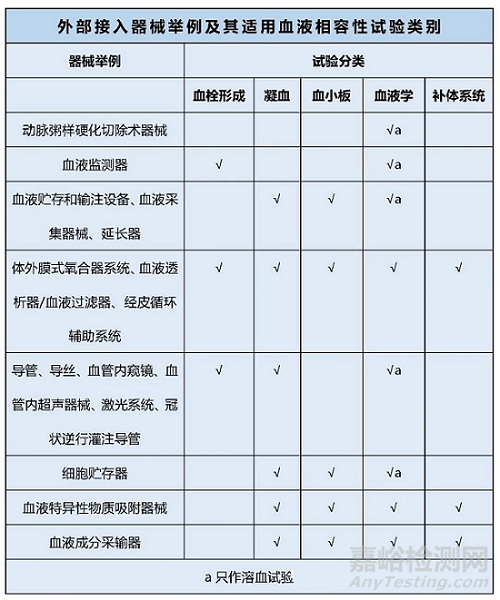
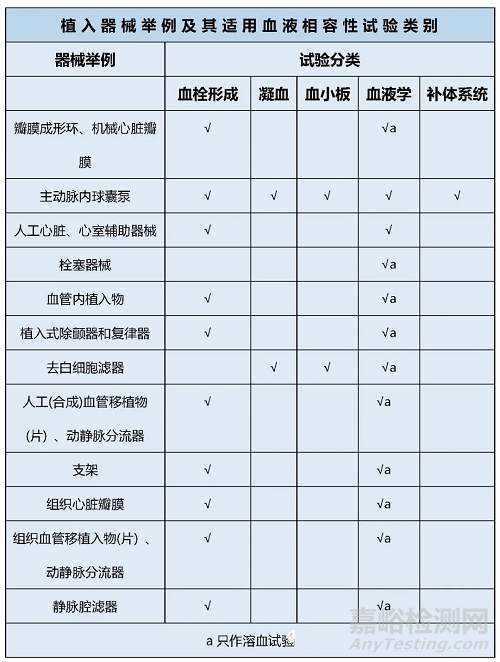
04医疗器械与循环血液接触器械举例和器械适用试验类别
医疗器械产品按照与循环血液接触分为外部接入器械和植入器械。标准GB/T16886.4-2003中给出了这两类器械的产品举例及使用的试验类别。
来源:国家药监局


