您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-12-08 15:28
为什么要设计固体分散体?
难溶药物的常见开发策略通常有四大类,其中,固体分散体能够有效地提高溶解度与溶解速率,从而促进药物的吸收。此过程中不改变药物分子结构,且具有制备工艺相对简单等优势,成为难溶性药物制剂开发中有效途径之一。
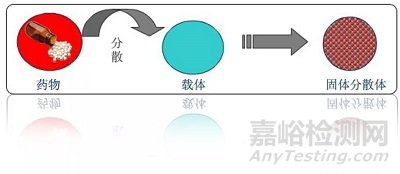
无定形药物固体分散体(Amorphous solid dispersion,ASD)是指将药物以无定形态在分子水平上均匀分散在载体中,形成的一种以固体形式存在的分散系统。固体分散体的概念由 Sekiguch 等人于 1961 年首次提出,经过几十年发展,目前已上市的固体分散体产品接近 30 种。
固体分散体的增溶原理
根据 Noyes-Whitney 方程: dC/dt=kDA(Cs-Ct) ,药物以分子状态分散到固体分散体中,因此可以提高药物溶出的表面积;采用亲水性高分子作为载体,可增加溶出常数;无定形态药物由于药物分子的无序排列,相比晶态具有更高的能量,因此具有高于晶态药物的饱和溶解度。综上,固体分散体对药物溶出的影响是多因素和多方面的。

固体分散体的缺点
由于固体分散体中药物的无序高能状态,易在制备、储藏等过程中转变成能量更低的晶态,如图 1 所示。结晶是固体分散体开发过程中面临的最大挑战,需要通过处方和制备工艺等调整对结晶进行抑制。
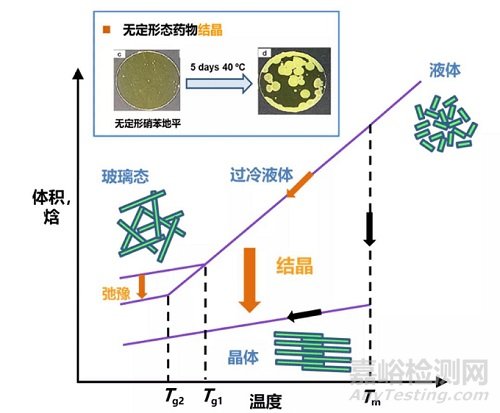
图1 晶态及无定形态药物的焓和体积对温度变化示意图
怎么做处方设计与制备?
固体分散体载体材料的选择:经过几十年的发展,目前基本确定了固体分散体载体材料选择的范围,多选用无定形态高分子聚合物。已上市的固体分散体产品也以这类载体为主,包括 PVP 、PVP/VA、HPC、HPMC 和 HPMCAS 等,也有一些其他类型高分子聚合物的固体分散体处于研究阶段。
添加表面活性剂:此外,为了更进一步提高固体分散体的溶出,可添加表面活性剂,例如固体分散体产品 Viekira™、Orkambi®、Afeditab®等,使用了 SLS、TPGS、泊洛沙姆等表面活性剂。
制备方法:常用的固体分散体制备方法包括热熔挤出、喷雾干燥、溶液蒸发、冷冻干燥、反溶剂沉淀、熔融冷却和机械研磨等。同时,越来越多新的制备方法被报道,比如微波制备和 3D 打印等。目前制药工业中常用的制备方法为喷雾干燥和热熔挤出。
喷雾干燥法
喷雾干燥法制备固体分散体,具有生产效率高、产物尺寸较小、不需要粉碎等优点。喷雾干燥需考虑的首要问题是选择合适的溶剂溶解药物和高分子,优先选择 ICH 溶剂分类里的 3 类溶剂(例如乙醇和丙酮等),应避免使用毒性大的 1 类溶剂。另外,仪器的喷嘴尺度、喷雾速率、入口和出口温度、雾化空气流量等参数是喷雾干燥过程中的关键工艺参数。此外,利用该法制备的固体分散体需要严格控制溶剂残留。
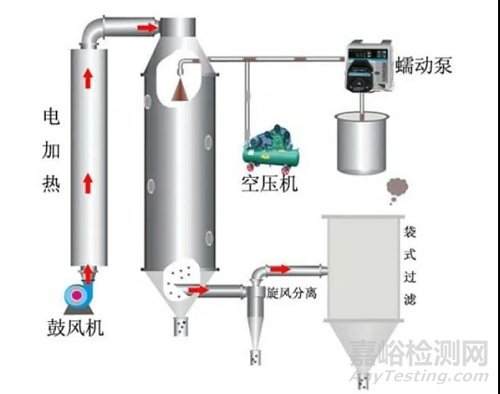
图 2 喷雾干燥机流程图
热熔挤出法
若药物的热稳定性较好,可优先考虑热熔挤出方法制备固体分散体。该方法无需考虑溶剂残留问题,适合连续化生产。热熔挤出的关键工艺参数包括加料速度、挤出温度、挤出速度和螺杆直径等。挤出产物需要进一步粉碎,需要监测粉碎过程中的机械力以及产热对产品理化稳定性的影响。根据文献,物料粘度在 1000-10000 Pa·s 适合挤出,但目前市场上的双螺杆挤出机一般能提供较大的扭矩,在实际工作中可挤出超过 10000 Pa·s 的物料,研发人员可根据仪器的实际情况进行评判。此外,为了降低热熔挤出的温度和粘度,可在处方中添加塑化剂。但是塑化剂的加入会降低体系的玻璃化转变温度,提高药物分子运动性,增加固体分散体结晶的风险,因此需要考察塑化剂对固体分散体稳定性的影响。
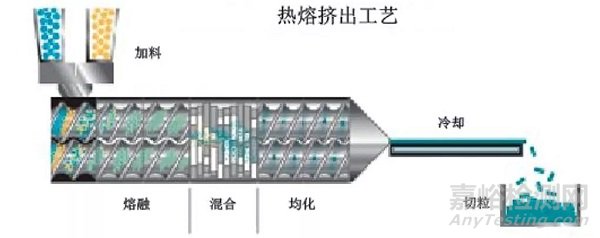
图3 热熔挤出工艺图
固体分散体是难溶药物提高溶解度的有效手段,其高效开发一方面离不开科学的处方设计及制备工艺研究,另一方面对于其成药性的优化也是关键环节。这其中对于无定形固体分散体的稳定性及溶解行为的控制通常是项目的难点,下边我们将专门探讨这一话题。
物理稳定性
与晶态物质相比,无定形态中分子具有更高的动能和热力学自由能,因此无定形态药物热力学稳定性不佳,容易结晶而失去增溶优势。无定形态药物易向晶体形式发生转变是其制剂开发过程中面临的重要挑战。
无定形态药物结晶受到多种因素影响,如下图 1 所示:
首先是药物自身的结晶趋势,药物自身结晶趋势越弱,越有利于开发成无定形态固体分散体。
其次,温度和湿度的影响,在分子扩散控制结晶区域内,温度越高分子运动性越快,结晶速率越高,而水分作为塑化剂,能显著降低固体分散体的玻璃化转变温度,提高药物的分子运动性,加速药物的结晶。
再次,由于分子在无定形固体表面具有较高的扩散速率,因此在表面更容易发生结晶。
另外,制剂工艺过程也可能影响无定形态药物结晶,例如粉碎、制粒、压片和包衣过程中涉及到机械力、产热和水分或溶剂等风险因素,均有可能加速无定形态药物结晶。
此外,聚合物、表面活性剂和增塑剂等辅料的选择也会影响无定形态药物的物理稳定性。
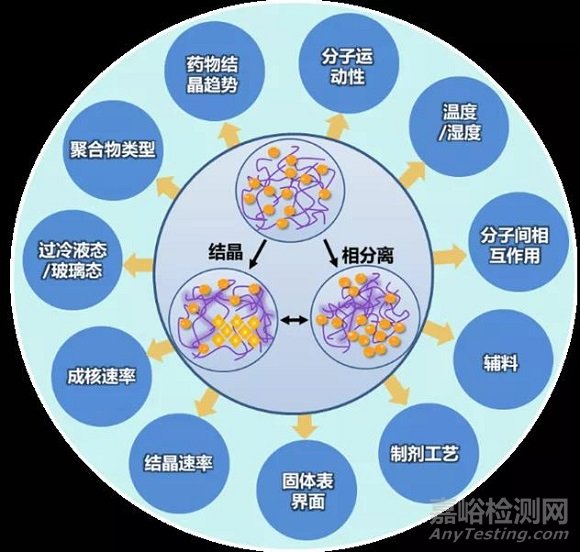
图1 固体分散体物理稳定性的影响因素
相分离和结晶都是影响固体分散体物理稳定性的高风险因素。采用 Flory-Huggins 理论等方法绘制药物和高分子的溶解度曲线和相分离曲线的相图,有助于评价药物和高分子是否互溶和筛选最优的高分子载体,同时还能用于评估储藏温度下的物理稳定性,甚至对于熔融法制备工艺参数的选择具有非常大的帮助。目前一般认为,高分子的反塑化效应,高分子的链段动能,高分子和药物之间的相互作用,包括范德华力、氢键相互作用和离子相互作用等是高分子稳定无定形态药物的主要机制[1]。
中国药典、FDA 指导原则、ICH Q6A 等部分涉及的多晶型检测分析方法适应于固体分散体的检测和鉴别,包括:X 射线粉末衍射、显微检测、热力学检测(DSC)、光谱学检测(红外、拉曼)、固态核磁等。由于不同监测手段灵敏度差异,实际工作中需要多种手段同时检测,结果相互印证。
溶出及生物利用度
固体分散体接触溶出介质后,可能发生相分离和结晶,溶出释放过程实际是药物释放和药物结晶的竞争过程,当药物释放速率大于药物相分离和结晶速率时,溶出释放较快;反之,溶出释放则受影响。载药量也是影响溶出速率的主要因素,载药量会影响药物和高分子的释放机制。目前文献表明,当载药量较低时,药物和高分子协同释放,药物可以快速释放;而高载药量时,高分子难以从固体分散体中释放,从而影响药物释放。崩解也是固体分散体溶出的重要影响因素,但是对于某些固体分散体,受到温度或者高分子的影响,固体分散体接触溶出介质后会形成胶状物,影响崩解进而影响溶出。此外聚合物载体性质、溶出介质、药物-聚合物的分子间相互作用和微观结构等因素也会影响释放。
抑制过饱和溶液中药物发生成核与结晶,可有效维持较高的药物浓度,提高生物利用度。溶出介质中,药物和高分子的相互作用可影响过饱和药物结晶和沉淀,界面吸附的高分子也可抑制晶体生长。此外,药物溶出达到过饱和后,难溶性药物可能发生液液分离(LLPS),形成药物富集的无定形聚集体,无定形聚集体可作为过饱和溶液维持的储库,有利于药物渗透吸收(图2)。为进一步提高溶出,固体分散体处方中可加入表面活性剂,但表面活性剂的引入可能会干扰药物和高分子之间的相互作用,削弱高分子维持药物过饱和状态的能力,从而对溶出和生物利用度造成不利影响。无定形态药物的结晶和相分离行为、过饱和程度、高分子和表面活性剂种类等因素也会影响过饱和溶液的维持,进而影响吸收。
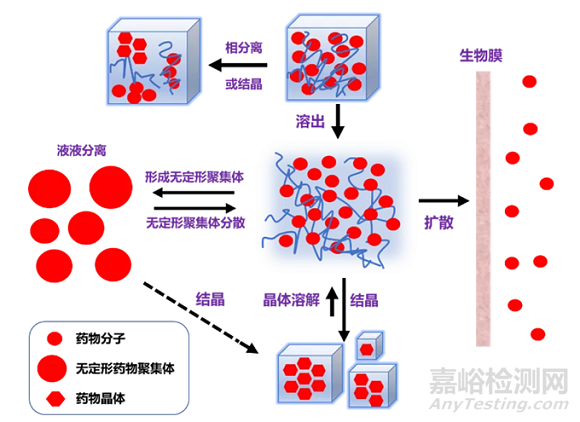
图2 固体分散体溶出过程示意图
例如,不同热熔挤出条件下制备的比卡鲁胺和 PVP/VA 的无定形固体分散体在非漏漕溶出过程中,研究发现完全的无定形固体分散体迅速达到较高的过饱和度,但由于无定形比卡鲁胺具有很快的结晶速率,亚稳态晶型 2 逐渐在表面结晶引发无定形固相结晶影响无定形药物释放;而如果热熔挤出工艺控制不佳,固体分散体内部会残余部分稳定晶型 1 ,溶出时达到的过饱和度较低,残余的晶体更易诱发无定形固相结晶,同时伴随药物浓度下降的去过饱和现象[2]。
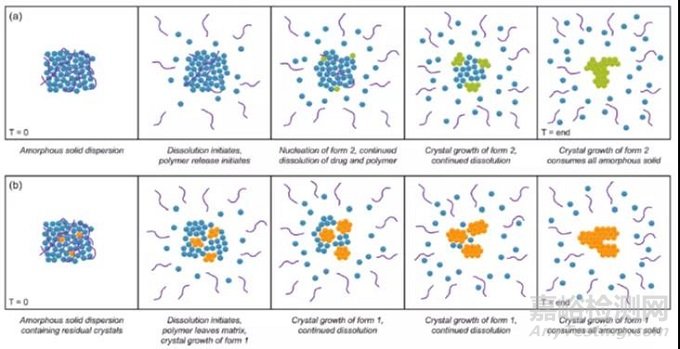
图3 不同残余晶体的比卡鲁胺的 PVP/VA 固体分散体的溶出行为
在另一项泊沙康唑和 HPMCAS 的固体分散体片剂的研究中,体外非漏槽溶出实验中含有表面活性剂 SLS 的固体分散体处方增加了药物的溶出,但是体内生物利用度结果却发现含有 SLS 的固体分散体的AUC反而降低了 30% 。通过进一步研究证明,泊沙康唑溶出后快速发生液-液分离,90% 药物形成含药富集相,而游离药物只占 10% 。体外溶出实验体现的是表面活性剂对游离药物的增溶作用,而对于体内吸收起决定性作用的含药富集相。SLS 存在下会与 HPMCAS 发生相互作用,从而竞争了 HPMCAS 对无定形药物聚集相的抑晶作用,从而影响了生物利用度,造成体内外结果不一致的情况[3]。
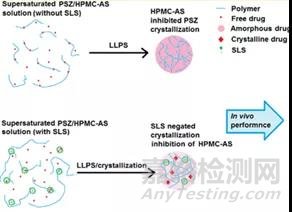
图4 泊沙康唑 / HPMCAS 固体分散体在 SLS 存在下的溶出行为
一般情况,体外溶出较好的固体分散体具有较高的生物利用度。处方开发中建立体内外相关性,可以更好地指导处方开发,筛选生物利用度最优的处方。但由于体内环境相比体外更加复杂,固体分散体溶出和吸收可能受到更多因素干扰,往往造成体外溶出和体内生物利用度不一致的情况,研发人员应予以关注。
参考文献
【1】Zhang, J.; Shi, Q.; Tao, J.; Peng, Y.; Cai, T. Impact of Polymer Enrichment at the Crystal−Liquid Interface on Crystallization Kinetics of Amorphous Solid Dispersions Mol. Pharmaceutics 2019, 16, 1385
【2】Moseson, D.; Corum, I.; Lust, A.; Altman, K.; Hiew, T.; Eren, A; Nagy, Z; Taylor, L Amorphous Solid Dispersions Containing Residual Crystallinity: Competition Between Dissolution and Matrix Crystallization. The AAPS Journal 2021, 23: 69
【3】Chen, Y.; Wang, S.; Wang, S.; Liu, C.; Su, C.; Hageman, M.; Hussain, M.; Haskell, R.; Stefanski, K.; Qian, F. Sodium Lauryl Sulfate Competitively Interacts with HPMC-AS and Consequently Reduces Oral Bioavailability of Posaconazole/HPMC-AS Amorphous Solid Dispersion. Mol. Pharmaceutics 2016, 13, 2787

来源:Internet


