您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-11-14 22:18
摘 要Abstract
目的:为全面掌握我国药物临床试验现状,对我国药物临床试验年度进展进行汇总和分析。方法:主要根据2020 年登记的药物临床试验信息,从临床试验概况、临床试验涉及的靶点和适应症领域分布情况、临床试验实施情况3 个方面对2020 年登记的药物临床试验的现状进行分析。结果:2020 年,药物临床试验登记与信息公示平台共登记1473 项药物临床试验,较2019 年总体增长22.5%。药物类型以化学药品和生物制品为主,注册分类中占比最高的均为1 类;国内申办者占比超过70%,试验范围以国内为主(85.9%);I 期临床试验占比最高(47.3%);受试者人群中儿童占比为8.8% ;靶点主要集中在PD1、VEGFR、CYP51A1 ;适应症主要集中在抗肿瘤和抗感染。47.4% 的首次新药临床试验申请(IND)获批品种未在1 年内启动临床试验。结论与建议:我国临床试验改革有效地促进了创新药物进入临床试验,国内制药企业已成为药物研发的重要力量,但也存在着靶点和适应症同质化以及实施效率不高等挑战。引导医药企业开展差异化的新药研发、鼓励新技术和新方法在临床试验中的应用以扩展儿科用药和提高临床试验效率,将帮助我国医药创新保持良性生态。
Objective: To present the current situation of drug clinical trials in China, a summary is made on the annual progress of new drug clinical trials. Methods: Based on the information of drug clinical trials registered in 2020, analysis is made from three aspects: clinical trial overview, targets and indications involved in clinical trials, and conduct of clinical trials. Results: In 2020, a total of 1,473 drug clinical trials were registered on the Drug Clinical Trial Registration and Information Disclosure Platform, an overall increase of 22.5% compared with 2019. Chemical drugs and biological products were the main drug types, with the highest percentage in Category 1 of the drug registration classification. The proportion of domestic sponsors was more than 70%, and most trials were conducted in China (85.9%). Phase I clinical trials had the highest percentage (47.3%), and children accounted for 8.8% of all trial subjects. PD1, VEGFR and CYP51A1 were the main drug targets, and drug indications were mainly focused on oncology and anti-infection areas. 47.4% Investigational New Drug (IND) applications were not initiated within one year of approval. Conclusion and Recommendations: China’s clinical trial reform has effectively accelerated the process of innovative drugs entering clinical trials. Domestic pharmaceutical companies have become an important force in drug research and development, but there are still challenges such as too much focus on a narrow set of drug targets and indications and low efficiency in conducting clinical trials. To create a favorable environment for drug innovation, it is necessary to guide pharmaceutical enterprises carrying out differentiated drug research and development, and encourage the application of new technologies and new methods in clinical trials to expand pediatric drugs and improve clinical trial efficiency.
关键词Key words
临床试验;监管科学;大数据
clinical trial; regulatory science; big data
在国家政策和法律法规的支撑下,我国已经建立一个相对完善的医药创新生态系统,国家药品监督管理局药品审评中心(以下简称药审中心)药品注册受理数量由2016 年的3779 件快速增长到2020 年的1 万余件,其中新药临床试验申请(investigational new drug,IND) 占比较高[1]。为全面了解我国药物临床试验现状,本研究基于药物临床试验登记与信息公示平台登记数据库和国家药监局国产药品及进口药品数据查询系统,分析了我国2020年药物临床试验情况,为业界新药研发、资源配置和药品审评审批提供参考,探索运用信息化手段提升药品智能监管能力。
1 资料和方法
1.1 资料来源和提取
自药物临床试验登记与信息公示平台数据库(http://www.chinadrugtrials.org.cn) 提取登记日期在 2020 年1 月 1 日至2020 年12 月31 日的药物临床试验,排除生物等效性试验。排除标准为符合以下一种或多种情况的临床试验:试验分类为“生物等效性试验”;试验分类其他说明中为“生物等效性试验”;试验目的为“生物等效性试验”。
1.2 数据处理和统计学方法
本研究从药物临床试验概况、药物临床试验涉及的靶点和适应症领域分布情况、临床试验实施情况3 个方面进行分析。药物临床试验概况重点分析内容包括数量特征、药物类型、申办方类型、试验特征(试验范围、试验分期、受试者人群)、药物注册分类、试验牵头单位分布等;药物临床试验涉及的靶点和适应症领域分布情况,其中适应症领域分布按照《国际疾病分类》第10版(International Classification of Diseases 10th Edition,ICD-10)的疾病分类标准分类;临床试验实施情况主要分析了首次IND 获批品种的临床试验启动时间,启动的定义为签署首例知情同意书。
2 结果
2.1 药物临床试验概况
2020 年,药物临床试验登记与信息公示平台共登记1473 项药物临床试验,较2019 年总体增长 22.5%。
从药物类型来看,化学药品801 项(54.4%)、生物制品605项(41.1%)、中药67 项(4.5%)。化学药品、中药、治疗用生物制品、预防用生物制品的注册分类中占比最高的均为1 类, 分别为71.2%、60.9%、65.4%、46.0%(图1)。
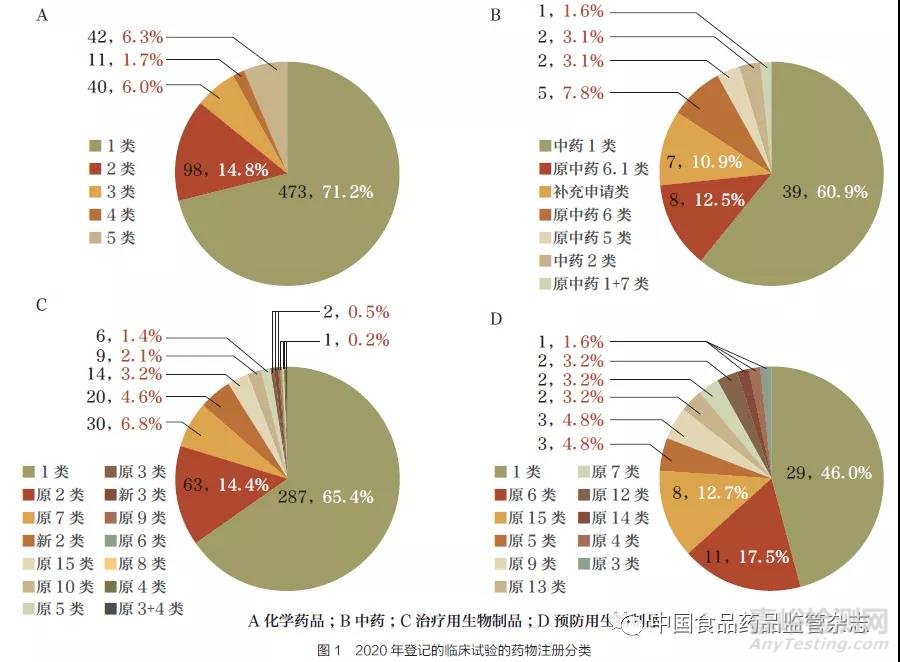
从临床试验范围来看,国内临床试验有1265 项(85.9%)。
从临床试验分期来看,I 期临床试验占比最高, 有643 项(43.7%),其次为III 期和II 期。
从申办方类型来看,国内制药企业发起的临床试验有1142项(77.5 %)。国内制药企业发起的国际多中心临床试验占比(7.6%) 低于全球制药企业(36.3%);国内制药企业发起的I 期临床试验占比(47.7%)高于全球制药企业(26.9%)
从受试者人群来看, 受试者为儿童的临床试验有129 项(8.8%)。
2.2 药物临床试验涉及的靶点和适应症领域分布情况
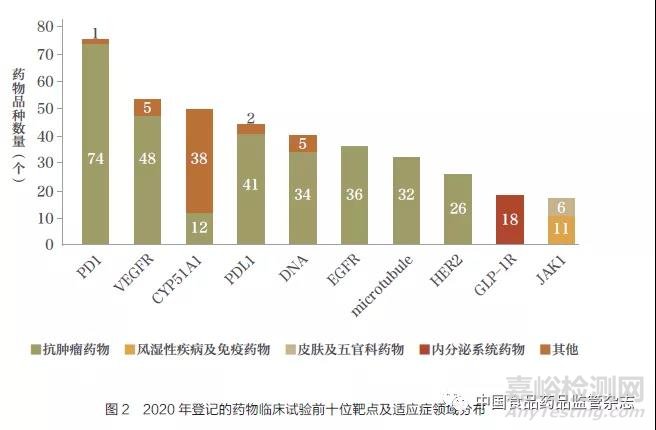
2020 年登记的药物临床试验涉及的靶点主要集中在PD1、VEGFR、CYP51A1,且药物品种数量分别多达75 个、53 个、50 个( 图2)。前十位靶点中,有9 个靶点的药物适应症集中在同一领域。其中,7 个靶点的药物适应症领域集中在抗肿瘤药物,占比超过90%。
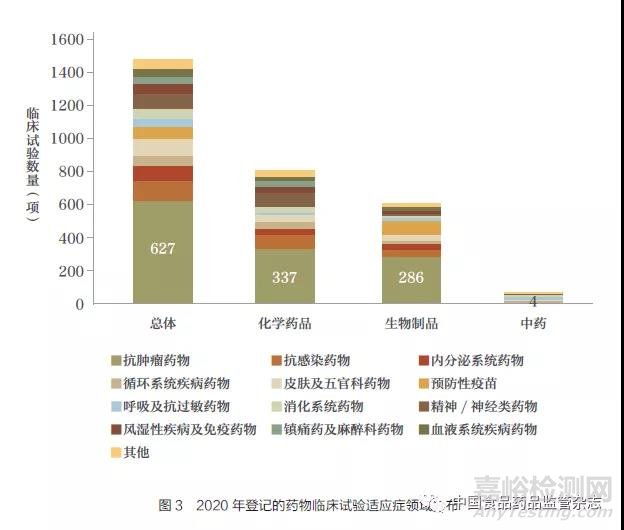
2020 年登记的药物临床试验涉及的适应症领域主要集中在抗肿瘤药物(42.6%),其次为抗感染药物(8.4%)、皮肤及五官科药物(6.0%)、内分泌系统药物(5.6%)。化学药品和生物制品临床试验适应症领域均主要以抗肿瘤药物为主(42.1% 和47.3%)。在生物制品临床试验中,预防性疫苗占比为13.9%。中药临床试验主要集中在呼吸及抗过敏药物、血液系统疾病药物和消化系统药物3 个适应症领域,约占中药临床试验总体的61.2%(图3)。
2.3 药物临床试验实施情况
2020 年登记的药物临床试验中, 首次IND 获批品种的临床试验平均启动时间为13.2 个月。非抗肿瘤药物的平均启动时间(14.3 个月)晚于抗肿瘤药物(11.5 个月),国内申办者的获批品种和抗肿瘤药物品种的启动时间均晚于国外申办者(表1)。
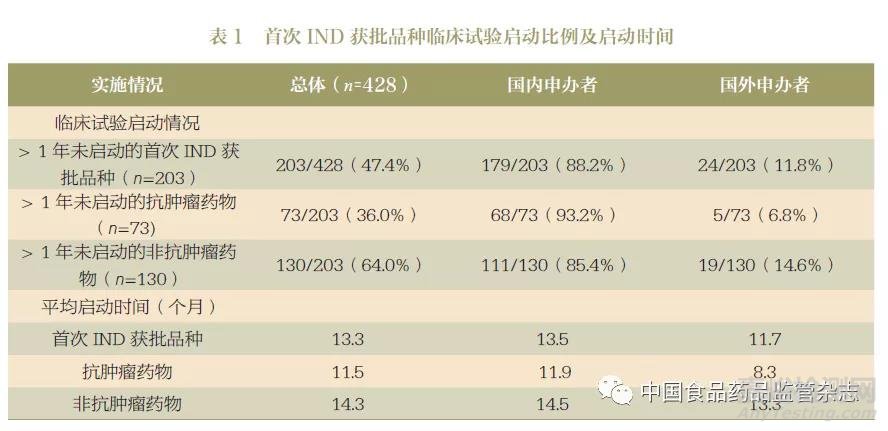
47.4% 的首次IND 获批品种未在1 年内启动临床试验;21.9% 的首次IND 获批品种未在2 年内启动临床试验。在首次IND 获批且未在1 年内启动临床试验的品种中,非抗肿瘤药物占比高达64.0%。
3 讨论
药物临床试验的开展情况是国家医药创新环境和改革成效的重要视角,也是未来医药创新趋势和药品监管思路的重要指导[2-5]。本研究结果显示,2020 年登记的我国新药临床试验的数量相较2019年大幅增加,主要由国内申办者发起,大量1 类创新药物进入临床试验,试验范围以国内为主,I 期试验阶段占比最高。表明我国临床试验改革有效地促进了药物临床试验的开展,国内制药企业已成为抗肿瘤药物研发的重要力量。
本研究结果显示,2020 年登记的药物临床试验涉及的适应症主要集中在抗肿瘤和抗感染。目前,在研临床试验的生物创新药物大部分为抗体类药物,且靶点集中度高,同质化竞争激烈。临床试验药物靶点和适应症领域过于集中会造成临床试验资源的浪费[6],导致我国临床试验受试者的招募越来越困难等一系列问题。
值得关注的是,药审中心已经针对个别研发过热的领域着手引导企业理性开发,将有限的审评资源用在具有明显临床价值的创新药物和急需药物上。2020 年药审中心开通了多条药品加快上市注册程序通道;近年制修订指导原则300 余个;2021 年上半年已有21 个1 类创新药物获批上市,且治疗领域主要涉及突发公共卫生事件应急所需防治药品以及肿瘤、罕见病和免疫系统疾病等临床急需药品,其中多个为我国自主研发并拥有自主知识产权的产品[7-9]。引导新药差异性研发是接下来的重要工作方向。
针对儿科临床试验周期长、招募困难、安全性风险高等因素,2021 年4 月15 日,药审中心发布了《用于产生真实世界证据的真实世界数据指导原则(试行)》,计划将针对全球尚未批准儿童应用,但境内外指南已明确推荐儿童应用的药品,进行回顾性研究或探索真实世界数据支持儿童用药研发的模式。本研究结果显示,儿科药物临床试验较少,主要为化学药品和生物制品,中药较少,且适应症领域主要为抗肿瘤药物和疫苗。通过遴选品种开展试点,提供儿童应用证据,支持说明书适应症扩展,解决临床经验性给药问题,将有利于消除广大儿童用药安全隐患。
本研究结果显示,2020 年登记的药物临床试验中,首次IND获批品种在1 年内启动临床试验的比例仅为52.6%,且国内申办者启动效率低于国外申办者,尤其是抗肿瘤领域。为提升药物临床试验在我国的开展、解决临床试验实施中的限速问题,药品监管部门相继出台默示许可制、伦理审查前置、药物临床试验机构备案制、取消分中心小结等一系列改革措施[6, 8, 10]。目前国内制药企业临床试验处于发展阶段,临床试验中操作和科学效率的优化需要研究人员和研究团队、申办者、监管机构以及其他利益相关者的共同努力,制定科学实施策略和应用先进的实施方法对于节省资源和时间、加速药物临床试验进展至关重要。在当今人工智能时代和疫情环境下,将可能符合条件的受试者与临床试验工具进行智能匹配正在成为现实,包括应用经过验证的电子签名代替手写签名以及远程监查等。
综上所述,我国临床试验改革有效地促进了药物临床试验的开展,大量创新药物进入临床试验,国内制药企业已成为抗肿瘤药物研发的重要力量,但也存在着靶点和适应症同质化以及实施效率不高等挑战。引导医药企业开展差异化的新药研发、鼓励新技术和新方法在临床试验中的应用以提高临床试验效率是未来的重点工作方向。

来源:中国食品药品监管杂志


