您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-27 16:12
关于分析方法验证,各国药典以及ICH Q2 定义基本相同,就是为了证明该分析方法与其预期目的相适应[1]。此定义既包含了对分析方法的强制性要求,也包含了对分析方法的一定容忍。强制性要求一般容易理解,因为需要对一系列评价指标进行验证,并且这些评价指标需要满足一定的验证要求。一定容忍表现在评价指标虽需要满足特定的要求,但并不一定要做到极致,而且在大多数的情况,由于受到检测样品、样品处理方法、检测设备的限制以及系统误差的存在,不可能做到极致。另外,在个别情况下,考虑到检测成本问题,在低成本检测即可满足检测需求的情况下,也不再考虑开发更高成本、更精确的检测方法。但是值得提醒的是,即使某些分析方法经验证已能满足目前的检测要求,但是与更加精确的检测方法相比,其因为检测方法的误差而造成检验结果偏差( out of specification,OOS) 的概率会更高[2]。因此,对于药物分析工作者来说,追寻更加精确的检测方法,始终是我们追逐的方向和目标。
1 方法学验证的内容
根据ICH Q2 以及各国药典方法学验证内容一般需要评价的典型验证项目有: 专属性、准确度、精密度( 重复性和中间精密度) 、检测限、定量限、线性、范围和耐用性等。根据分析方法的类型不同,需要验证的项目不同,见表1。
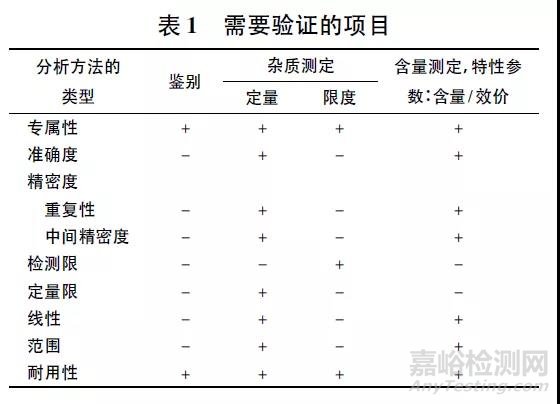
4 种最常见的分析方法类型中,鉴别实验仅需要验证专属性和耐用性; 含量测定( 含量/效价) 需要验证专属性、准确度、重复性、中间精密度、线性、范围和耐用性,上述2 种类型分析方法的验证内容目前争议较小。但对于杂质检查时,哪些杂质需要进行定量检测,哪些杂质需要进行限度检测,目前国内研发工作中存在一定的争议。部分企业为了保证研发资料的全面性,将杂质谱分析所有杂质检查均归类为定量检测进行验证; 部分企业则认为所有杂质既然均规定了限度,那么杂质只要低于此限度就是安全的,所以所有杂质只要做限度检测即可。
笔者认为以上观点均存在一定的偏颇。将所有杂质谱分析可能存在的杂质均归类为定量检测进行验证,从申报来说,风险较低,但从研发成本以及时间来说,却造成浪费,不值得推荐。但是不是所有杂质只要做限度检测就可以了,哪些杂质需要做定量检测,哪些杂质只需做限度检测,应予以区分。
首先,回归到方法学验证的定义: 证明该分析方法与其预期目的相适应。我们需要了解做杂质检查的目的,是为了保证药品质量和临床用药安全,保证杂质含量始终在界定限度以下。从杂质检查的目的可以看出,如果是保证杂质含量某一次在界定限度以下,那么可以认为只需做限度检测即可。但这里强调的是始终,包括没有被检测到的样品。这就要求我们结合风险管理和统计学来综合评估。
我们需要了解ICH Q3A 和ICH Q3B 中的一个术语即报告限度( 或报告水平) ,其为一限度,高于此限度的杂质需报告其含量。根据ICH Q3A 和ICH Q3B,低于报告限度的杂质不需要报告其含量,由此可以确定,含量低于报告限度的杂质只需要做限度检查而没有必要做定量检测。按照报告限度的定义来说,高于此限度的杂质需要报告其含量,也就是说需要定量检测。
高于报告限度的杂质必须要做定量检测的原因如下: 首先只有准确检测了某杂质的含量,才能有良好的数据积累,对产品的批间稳定性有更好了解,对工艺有更好把握; 其次只有准确检测了某杂质,才能够更加了解其超出限度的可能性的高低,从而制定相应的控制策略; 另只有准确检测了某杂质,才能了解关键临床批次的质量,为某些特定杂质提供限度制定的依据。有观点认为把低于报告限度的杂质也准确检测更好,但从风险管理角度来看,必要性不强,获益性较低。
另外,上述提到的小于报告限度的杂质是指稳定性考察期间均小于报告限度的杂质只需做限度检查,如果稳定性考察期间有超出报告限度的情况,建议仍做定量检测。有的研发者可能提出,一般情况下,方法学验证均在稳定性实验之前,所以在要进行方法学验证时,并不能判断其是否始终低于报告限度。笔者认为确实如此。但在方法学验证时,根据前期研究数据、文献资料等,可以提前预判。在开展稳定性研究后,如果发生了变化,那么验证类型也可以再做调整。
对于高毒性杂质,由于其安全限度极低,已不能按照ICH Q3A 或ICH Q3B 来确定其报告限度。为了积累更多的数据,保证产品安全,如检测条件允许,此类杂质建议按定量检测进行控制。其实,所有提出的高要求,总是需要存在与之相适应的外部条件的。检测方法也是一样,更加严格的检测要求是为了满足更高的安全性要求,也是与更加精密的检测设备以及不断推陈出新的新型检测方法相关联的。
2 方法学验证的可接受标准
2.1 专属性
一些国际机构倾向于使用“选择性”一词[3],因为一般一种分析方法不太可能对某一特定的被分析物具有专属性( 完全识别) 。在考察一个分析方法的选择性时,应着重考虑杂质、降解产物、相关化合物以及制剂辅料等其他组分对被测物的干扰。
2.2 线性
线性系指在分析方法范围内,检测结果与供应品中被测物的浓度( 量) 直接或间接呈线性关系的程度,是定量测定的基础,涉及定量测定的项目,如杂质定量试验和含量测定均需验证方法的线性。
2.3 范围
特定的范围一般是从线性研究中得到的,并取决于分析方法的预期应用。确定范围的方法是指样品中含有被分析物的量,无论在范围内或在范围末端,该分析方法均能获得良好的线性、精密度和准确性。
一般情况下,对原料药或成品的含量测定应在测试浓度的80% ~ 120%; 含量均匀度检查应在测试浓度的70% ~ 130%; 溶出度测试应为规定范围的± 20%; 杂质检查应为杂质报告水平至规定限度的120%。
2.4 准确度
分析方法的准确度是指真实值或认可的参考值与测量值之间的接近程度。具有一定的准确度是进行定量测定的必要条件,因此,涉及定量测定的检测项目均需要验证方法的准确度。如含量测定、杂质定量实验等。准确度应在规定的范围内建立。
2.5 精密度
分析方法的精密度指的是规定条件下对均质样品多次取样进行一系列检测结果的接近程度( 离散程度) 。精密度可以从3 个层次考虑: 重复性、中间精密度、重现性。
2.6 检测限
某一分析方法的检测限度是样品中的被分析物能够被检测到的最低量,但不一定要准确定量。
2.7 定量限
某一分析方法的定量限度是指在合适的准确性和精密度下,能够定量测定样品中被分析物的最低量。
2.8 耐用性
分析方法的耐用性是指在实验参数被故意地发生细小改变时,检测不受影响的能力,用于说明正常使用时的可靠性。
从目前国内提交的申报资料来看,检测限和定量限评价一般采用信噪比的方法来确定,存在问题较小,专属性研究也较为完善,线性和范围报告也基本全面,存在问题较大或者争议较多的是准确度和精密度的数据报告。
ICH Q2( R1) 要求准确性应通过在样品中加入已知量的被分析物测得的百分回收率或平均值与实测值的差异及其置信区间来报告。从目前的申报资料来看,绝大多数申请人选择报告平均百分回收率来说明方法的准确度,因为此种方法较为直观和方便统计,并且可以参考药典要求对分析方法的准确度进行简单的评判。
经查询《中华人民共和国药典》2020 年版四部通则9101[4]“分析方法验证指导原则”项下,关于准确度和精密度的数据要求的参考值见表2。部分申请人提出某些方法难以满足上述要求。这里要说明的是表2 中给出的回收率和精密度数据要求仅为参考值,建议一般的分析方法应该满足上述的准确度和精密度要求。但对于达不到上述要求的分析方法,申请人只要能证明建立的分析方法的准确度和精密度能够满足检测目的要求,如果分析方法造成OOS 的概率可接受,那么该方法仍可用。
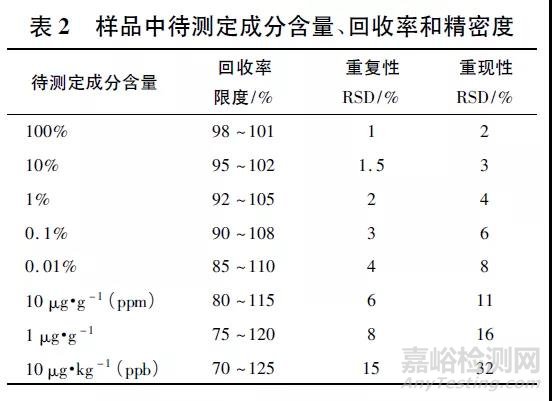
分析方法的误差主要来自验证项目的准确度和精密度,但某一分析方法可能造成OOS 的概率或总的误差,从目前的方法学验证结果中很难得到结论。目前已经有许多机构及组织注意到这一点,在完成一种方法学验证后,期望得到该方法适用的结论,就需要给出其可能造成误测的总概率,这样能更好地运用此方法。
目前USP-NF1210-2018 已经提出对准确度和精密度进行合并验证[5],从而得出分析方法的总误差。ICH Q2( R2) 在修订过程中也提出建议在方法学验证数据报告时需报告总的方法误差。
总之,分析方法是为检测目的而建立的,验证的目的就是为了证明分析方法的适用性,但适用性也是相对的。建立一个误差为零的分析方法是每个分析工作者的终极目标,但也是一个不可能完成的目标。分析方法验证的真实目的就是了解该方法最终提供给我们的数据的真实程度。


来源:中国新药杂志


