您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-10-19 09:31
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
生物安全法表决通过。十三届全国人大常委会第二十二次会议表决通过了生物安全法。生物安全法共计十章八十八条,自2021年4月15日起施行。法律第五十六条规定明确,为了取得相关药品和医疗器械在我国上市许可,在临床试验机构利用我国人类遗传资源开展国际合作临床试验、不涉及人类遗传资源出境的,在开展临床试验前将拟使用的人类遗传资源种类、数量及用途向国务院科技主管部门备案即可。
国内药讯
1.东阳光甘精胰岛素注射液申报上市。东阳光甘精胰岛素注射液上市申请获CDE受理。甘精胰岛素注射液是一种新型的胰岛素类似物,由赛诺菲原研,已获批用于治疗1型和2型糖尿病。2004年,赛诺菲甘精胰岛素注射液获批进口中国,商品名为来得时。该品种国内获批的生产厂家有甘李药业、珠海联邦制药和通化东宝。数据显示,2019年国内糖尿病领域药物销售金额为39.21亿美元,其中胰岛素及其类似物类药物销售金额的份额为42.52%。
2.北陆药业钆布醇注射液申报上市。北陆药业钆布醇注射液仿制4类上市申请获CDE受理。米内网数据显示,2019年中国公立医疗机构终端造影剂销售额已超过150亿元,在产品TOP20中,钆布醇注射液排在第18位,生产厂家仅有拜耳一家。近年该产品销售额快速增长,2019年增长率超过70%。在此之前,恒瑞医药钆布醇注射液以仿制4类提交上市申请,目前正在审评审批中。
3.杨森靶向疗法Amivantamab在华进入突破性治疗药物程序。NMPA批准强生旗下杨森新型双特异性抗体amivantamab (JNJ-61186372, JNJ-6372)纳入突破性治疗药物程序,用于治疗含铂双药化疗期间或之后进展,或对含铂化疗不耐受的携带EGFR 20号外显子插入突变的转移性或手术不可切除的非小细胞肺癌患者。目前,在中国或全球其他地方都尚未批准过靶向治疗EGFR 20号外显子插入突变非小细胞肺癌患者的疗法。
4.众生药业流感新药进入III期临床。众生药业旗下众生睿创1类创新药ZSP1273片获得Ⅲ期临床试验伦理批件,即将开展用于治疗成人单纯性甲型流感的Ⅲ期临床。ZSP1273片是国内首个获批临床试验的治疗甲型流感的小分子RNA聚合酶抑制剂,也是同类药物临床研究进展最快的产品。广州医科大学附属第一医院钟南山院士作为 ZSP1273片Ⅱ期临床研究的总项目负责人(PI),将继续作为 Ⅲ期临床的总项目负责人,负责主导ZSP1273的临床研究工作。
5.拜耳在研癌症免疫新药在华申报临床。拜耳1类新药BAY 2416964片的临床申请获CDE受理。BAY 2416964是一款高选择性芳香烃受体(AhR)抑制剂,在全球处于Ⅰ期临床开发阶段,此次是这款在研药物首次在华申报临床。2020年4月,拜耳在AACR2020会议上发布了BAY 2416964的临床前研究结果。研究证明,它是一种强效、选择性和交叉反应性的AhR,能够发挥多种抗肿瘤免疫调节作用。
6.复宏汉霖与亿胜达成独家许可协议。复宏汉霖宣布与亿胜生物旗下全资附属子公司亿胜生物投资及珠海亿胜(合称“亿胜”)签订了一项共同开发及独家许可协议,双方将合作开发复宏汉霖开发与生产的贝伐珠单抗生物类似药HLX04治疗湿性年龄相关性黄斑变性(wAMD)等眼科适应症,同时复宏汉霖授予亿胜在全球范围内针对眼科适应症进行注册开发、生产及商业化的独家许可权。根据协议,复宏汉霖将获得高达4300万美元的签约、监管和商业里程碑付款,以及产品的销售分成。
国际药讯
1.默沙东Keytruda新扩适应症获FDA批准。默沙东PD-1疗法Keytruda获FDA批准扩大适应症,单药治疗复发/难治性经典型霍奇金淋巴瘤(cHL)成人患者。FDA同时还批准了Keytruda用于难治性cHL,或经二线及二线以上治疗后复发的cHL儿童患者。在一项Ⅲ期临床KEYNOTE-204中,与标准疗法相比,Keytruda使患者疾病进展或死亡风险显著降低了35%(HR=0.65,95% CI,0.48-0.88;p<0.0027)。Keytruda治疗组患者的中位无进展生存期(PFS)为13.2个月,而标准疗法治疗组患者的PFS为8.3个月。
2.抗HIV长效疗法获欧盟CHMP推荐批准。欧洲药品管理局人用药品委员会(CHMP)推荐批准ViiV Healthcare与杨森联合开发的长效注射方案(卡博特韦/利匹韦林)上市,治疗曾接受抗逆转录病毒治疗方案且达到病毒学抑制的HIV-1感染成人患者。在Ⅲ期ATLAS和FLAIR研究中,每月1次注射卡博特韦/利匹韦林在维持病毒抑制方面与继续每日1次口服抗逆转录病毒治疗方案同样有效。在关键性ATLAS-2M试验中,每2个月使用一次卡博特韦/利匹韦林的抗病毒活性和安全性与每月一次给药相比,达到非劣效性标准。
3.吉利德套细胞淋巴瘤CAR-T疗法欧盟即将获批。吉利德科学旗下Kite公司CAR-T细胞疗法Tecartus(brexucabtagene autoleucel)获欧洲药品管理局人用医药产品委员会(CHMP)建议有条件批准上市,用于治疗先前接受过2种或多种系统疗法(包括一种BTK抑制剂)的复发或难治性套细胞淋巴瘤(R/R MCL)成人患者。今年7月,FDA加速批准Tecartus用于治疗R/R MCL成人患者。在美国和欧盟,Tecartus曾分别被授予了突破性药物资格和优先药物资格。
4.NIH启动一项探索COVID-19潜在疗法的Ⅱ期临床。美国国立卫生研究院(NIH)下属的国家过敏和传染病研究所(NIAID)启动一项Ⅱ期临床ACTIV-5/BET,评估勃林格殷格翰/艾伯维IL-23抗体risankizumab(Skyrizi)与瑞德西韦联用,以及Humanigen公司在研GM-CSF中和抗体lenzilumab与瑞德西韦联用,和同一组对照组(安慰剂与瑞德西韦联用)相比治疗COVID-19住院患者的效果。这项试验将在美国接近40个试验点开展,每组疗法将注册大约100例COVID-19住院患者。
5.地塞米松仍是唯一对新冠重症有效药物。当地时间10月16日,世卫组织举行新冠肺炎例行发布会,世卫组织总干事谭德塞表示,“团结试验”中期结果表明,瑞德西韦、羟氯喹、洛匹那韦/利托那韦以及干扰素治疗在防止新冠肺炎患者死亡或缩短住院时间上几乎没有效果,“团结试验”将评估其他疗法,包括单克隆抗体和新型抗病毒药。目前对于新冠肺炎重症患者来说,地塞米松仍是唯一有效的药物。
6.礼来囊获创新SARM1抑制剂。礼来宣布与Disarm公司达成收购协议,将获得Disarm公司发现的创新SARM1抑制剂。SARM1蛋白是引起广泛神经系统疾病中轴突变性的核心驱动因素。Disarm的SARM1抑制剂旨在直接阻止轴突的丢失,为外周神经病变和其他神经系统疾病(如肌萎缩侧索硬化症和多发性硬化)患者提供突破性治疗。根据协议,Disarm股权持有人将获得1.35亿美元的前期付款,以及可能高达12.25亿美元的额外里程碑付款。
医药热点
1.青岛新冠疫情溯源结果公布。青岛市16日召开新闻发布会公布青岛疫情溯源情况。据介绍,此次疫情发生后,山东省领导小组第一时间组建流调溯源工作专班,以及重点人群分类检测和基因病毒测序专班,全面排查3个传播途径主要环节。经专家组综合现场流行病学调查、大数据排查和实验室检测结果分析,以及该医院监控录像证实,判定青岛本轮疫情是新冠病毒感染者在住院期间,与普通区患者共用CT室引发的医院院内聚集性疫情,未发生社区传播。
2.冷链食品外包装分离出新冠活病毒。据央视网消息,中国疾控制中心对青岛新冠肺炎疫情溯源调查过程中,从进口冷冻鳕鱼的外包装阳性样本中检测分离到活病毒。这是国际上首次在冷链食品外包装上分离到新冠活病毒,并证实接触新冠活病毒污染的外包装可导致感染。中国疾控中心建议与进口冷链产品有密切接触的从业人员,增强防护意识,做好日常防护,定期进行核酸筛查。
股市资讯
【九典制药】公司收到国家药品监督管理局下发的1类名为“枸橼酸氢钾钠颗粒”药品注册证书。
【广生堂】公司新型肝癌靶向药物GST-HG161获得乌克兰专利授权通知书,非酒精性脂肪肝病及肝纤维化可逆转新药GST-HG151获得中国台湾地区专利授权通知书。
【景峰医药】公司之子公司海南锦瑞制药有限公司获得国家药品监督管理局下发的《受理通知书》,由海南锦瑞制药有限公司提交的“注射用兰索拉唑”一致性评价补充申请已获正式受理。
审评动向
1. CDE最新受理情况(10月18日)
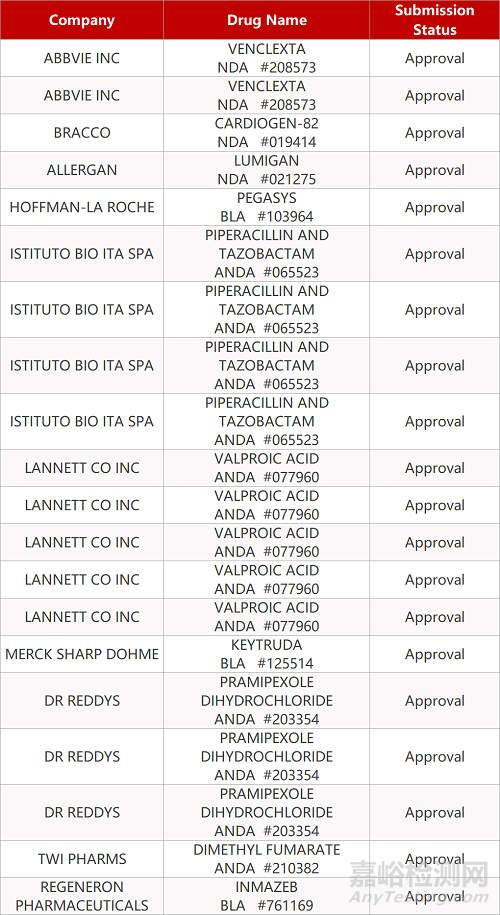
2. FDA最新获批情况(北美10月16日)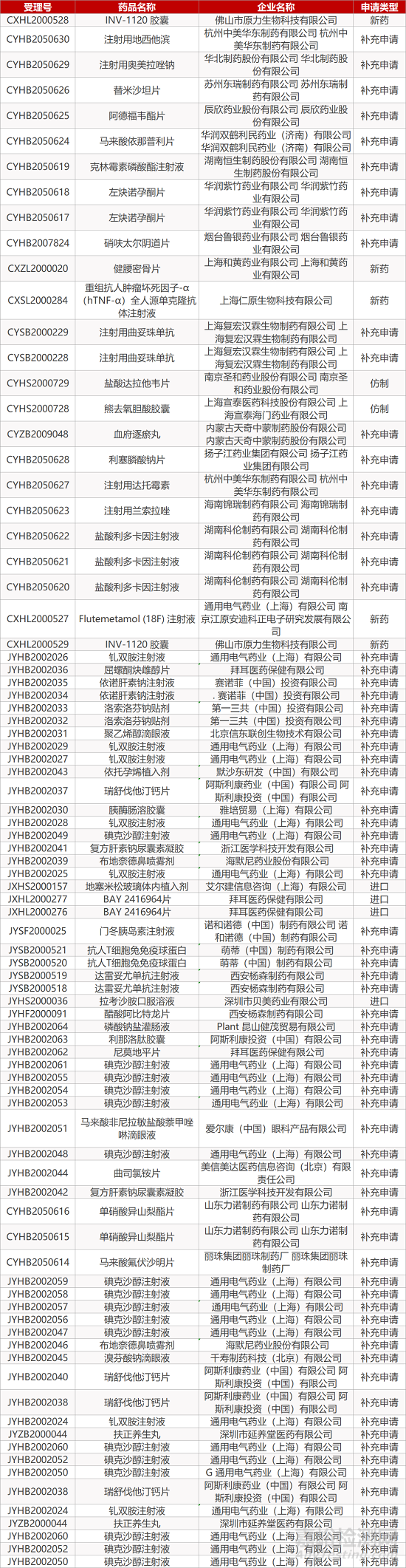
- The End -

来源:药研发


