您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-07-14 09:51
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.碳酸司维拉姆片国内首仿获批。恒生制药4类仿制药碳酸司维拉姆片获国家药监局批准上市,为该品种国内首个仿制药,用于控制正在接受透析治疗的慢性肾脏病(CKD)成人患者的高磷血症。该药原研由赛诺菲开发,2013年6月获批进入中国。目前国内获批上市的终末期肾病透析患者高磷血症治疗的药品主要有司维拉姆和碳酸镧,2018年这两款药品的中国销售额约为3.53亿元。
2.健进制药盐酸苯达莫司汀拟纳入优先审评。7月9日,健进制药注射用盐酸苯达莫司汀上市申请获CDE纳入拟优先审评公示名单,纳入理由为“同一生产线生产,已于2020年在美国上市,申请国内上市”。注射用盐酸苯达莫司汀(商品名:Treanda)是由Cephalon公司开发的一种双功能基烷化剂,于2008年3月获FDA批准上市,用于慢性淋巴细胞白血病和非霍奇金淋巴瘤的治疗。目前国内该产品除原研(商品名:存达,100mg)外,国内企业仅有正大天晴的25mg规格获批。
3.晟德CS02糖尿病Ⅱ期临床结果达标。晟德大药厂旗下糖尿病候选新药CS02在台湾、美国开展的Ⅱ期临床结果积极。结果显示,CS02可有效降低糖化血色素(HbA1c)达0.45%(P值=0.0098);并且使患者胰岛β细胞功能指数(HOMA2-β)平均上升13.45%。据悉,CS02的母药是一款心血管老药,兼具改善心血管疾病的治疗优势以及降血糖的效果。目前晟徳正积极布局全球伙伴的授权与合作开发。
4. 君实新冠中和抗体Ⅰ期临床完成受试者入组。君实生物与中国科学院微生物研究所共同开发的重组全人源抗SARS-CoV-2单克隆抗体注射液(JS016)中国Ⅰ期临床完成所有受试者给药。该研究由复旦大学附属华山医院的张菁教授和张文宏教授牵头,旨在评价JS016单剂静脉输注给药在健康受试者中的耐受性和安全性,共招募40例健康受试者(男女均有)。JS016是中国最早进入临床的新冠病毒中和抗体之一,其在美国的临床试验也于第二季度启动。
5.应世生物IN10018胃癌I期临床首例给药。应世生物旗下黏着斑激酶(FAK)抑制剂IN10018治疗晚期胃或胃食管交界处(GEJ)腺癌的I期临床已在上海同济大学附属东方医院完成首例患者给药。该研究旨在评估IN10018单药以及联合多西他赛作为二线或后线治疗的安全性、耐受性、抗肿瘤疗效以及药代动力学(PK)特征。IN10018目前在美国、澳洲和中国均处于临床开发阶段,应世生物拥有该化合物的全球独家开发和商业权益。
国际药讯
1.全球首个COVID-19生物药Itolizumab在印度获批。印度最大生物制药公司百康宣布,印度药品管理总局已批准Itolizumab(25mg/5mL,ALZUMAb®,静脉制剂)用于COVID-19导致的中重度急性呼吸窘迫综合症(ARDS)患者,治疗细胞因子释放综合征(CRS)。Itolizumab是一种新型免疫调节抗CD6 IgG1单抗,已于2013年在印度获批上市,该药也是全球首个抗CD6单抗,以品牌名ALZUMAb销售,用于治疗慢性斑块型银屑病患者。Itolizumab是全球首个获批用于治疗中重度COVID-19并发症的新型生物制剂,也是印度批准的第三款COVID-19的治疗药物。
2.FDA批准第6款阿达木单抗生物类似药。FDA批准迈兰与协和麒麟开发的Hulio(adalimumab-fkjp)上市,该药是艾伯维旗舰产品阿达木单抗(adalimumab,Humira)的生物类似药,用于治疗多种自身免疫性疾病,包括类风湿性关节炎、幼年特发性关节炎、银屑病关节炎、强直性脊柱炎、成人克罗恩病、溃疡性结肠炎、斑块型银屑病。在一项Ⅲ期ARABESC研究中,Hulio与Humira相比达非劣效性标准。这是FDA批准的第6个阿达木单抗生物类似药。
3.盐野义流感药物Xofluza III期临床结果积极。盐野义内切核酸酶抑制剂Xofluza(baloxavir marboxil)用于流感患者的家庭成员作为流感暴露后预防措施III期BLOCKSTONE研究的全部结果已发表于《新英格兰医学杂志》(NEJM)。与安慰剂相比,Xofluza将流感患者家庭成员发生临床流感的风险显著降低了86%;两组发生流感的受试者比例为1.9%和13.6%,具统计学意义(p<0.0001)。此外,两组不良事件发生率分别为22.2%和20.5%,Xofluza未报告严重不良事件。根据BLOCKSTONE研究结果,盐野义已在日本和中国台湾提交了Xofluza作为暴露后预防性治疗的补充申请。
4.Maruho新型抗炎药nemolizumab达Ⅲ期临床终点。Maruho公司IL-31受体A靶向阻断抗体nemolizumab治疗特应性皮炎(AD)相关瘙痒的III期研究结果已发表于《新英格兰医学杂志》(NEJM)上。结果显示,治疗第16周VAS(基线瘙痒视觉模拟量表)评分相对基线检查的变化率,nemolizumab组为-42.8%,安慰剂组为-21.4%,差异具统计学意义(p<0.001),达主要终点指标;该研究同时也达到包括EASI(湿疹面积及严重程度指数)评分等多个次要终点。此外,两组不良事件发生率为71%,且多数为轻中度。
5.赛诺菲与Kymera公司达成合作协议。Kymera Therapeutics与赛诺菲达成多项目战略合作,联合开发和商业化针对IRAK4的“first-in-class”蛋白降解疗法,治疗免疫炎症疾病。根据协议,Kymera将获得1.5亿美元前期付款、可能超过20亿美元的潜在里程碑付款以及产品的销售额分成;Kymera将负责推进IRAK4项目完成Ⅰ期临床,此后赛诺菲将承担后续临床开发和推广;赛诺菲将负责第二个研发项目的所有临床开发活动;Kymera可选择参与这两个项目在美国的临床开发;Kymera将保留其IRAK4项目在肿瘤学适应症方面的全球权益。
6.默沙东扩大与Zymeworks公司的研发合作。Zymeworks公司与长期合作伙伴默沙东签署了一份最新许可协议,授予默沙东使用其Azymetric™和EFECT™平台开发多特异性抗体治疗候选药物的权利。根据新协议,Zymeworks将向默沙东提供全球性、具有专利权的使用许可,以研究、开发和商业化三款专门针对默沙东治疗靶标的新多特异性抗体;Zymeworks将获得预付款、潜在的4.11亿美元的期权行使费、临床开发和监管批准里程碑付款,以及4.8亿美元的商业里程碑付款和全球销售的分层版税。
医药热点
1.北京连续7天无新增病例。7月12日0时至24时,北京无新增报告本地确诊病例、疑似病例和无症状感染者,治愈出院病例14例;无新增报告境外输入确诊病例、疑似病例和无症状感染者。6月11日0时至7月12日24时,北京累计报告本地确诊病例335例,在院226例,治愈出院109例。尚在观察的无症状感染者18例;无新增报告境外输入新冠肺炎确诊病例、疑似病例和无症状感染者。据悉,北京市已连续7天无新增报告本地确诊病例。
2.北京儿童医院安检升级。7月1日起,《北京市医院安全秩序管理规定》正式实施,为了进一步落实相关要求,首都医科大学附属北京儿童医院升级安检机制。据介绍,此次将过去在门、急诊楼前的安检前移至入院前安检,将过去“安检门+手持安检”升级为“安检门+X光机+手持安检”。通过设备技术提升,新型智能安检门可同时实现安检、测温和人证比对功能,而且安检门一旦发现违禁物品即会以红色显示物品所在位置,丝毫不影响入院通行速度。
3.辽宁今年招定向医学生100名。辽宁省卫健委等6部门印发了《2020年度辽宁省农村订单定向医学生免费培养工作实施方案》提出,2020年全省农村订单定向医学生免费培养招生计划为100名。农村订单定向医学生免费培养计划由辽宁省教育厅列入2020年度普通高等学校定向就业招生计划,定向培养承办院校为辽东学院,定向培养专业为临床医学专业专科(三年制)。这些医学生毕业后,到辽宁省各市定向就业县欠发达的农村地区乡镇卫生院就业,经系统性全科医学强化培训后,从事全科医疗工作。
股市资讯
【华海药业】子公司华博生物及华奥泰收到国家药监核准签发的 HB0017 注射液项目两个新适应症银屑病关节炎和强直性脊柱炎的《临床试验通知书》。
【达安基因】公司上修2020半年度业绩预告,修改后半年度盈利6.2-8.0亿元,同比增长924.57%-1222.03%。
【溢多利】公司向特定对象金大地投资、明信投资、温氏投资和菁阳投资发行股票不超过6054.5万股股份,募集资金不超过6亿元,发行的股票数量上约占本次发行前公司总股本的13.8%。
审评动向
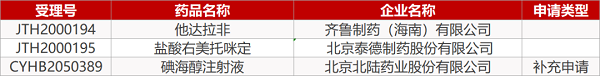
1. CDE最新受理情况(07月13日)
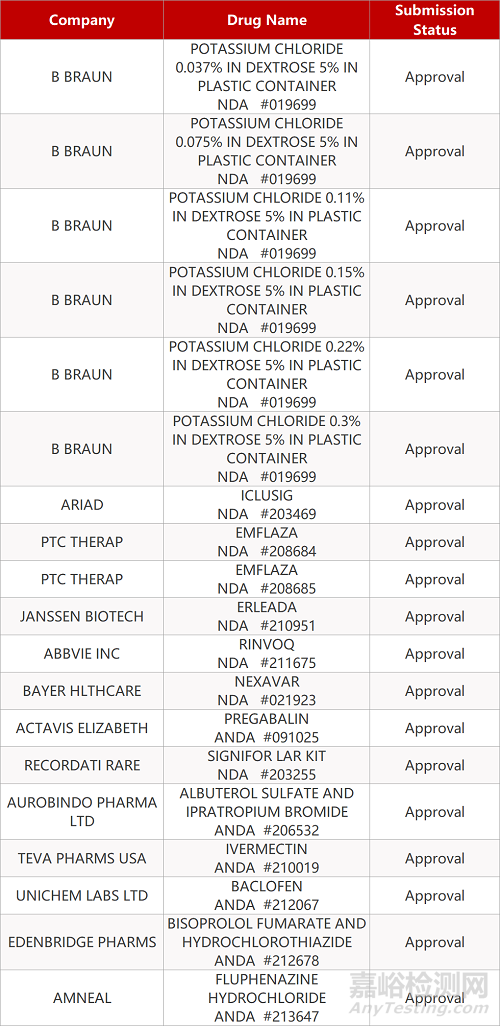
2. FDA最新获批情况(北美07月10日)
- The End -

来源:药研发


