您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-07-03 14:52
《中国药典》原料药物与制剂稳定性试验指导原则主要变化对比
|
项目 |
试验条件 |
2020版中国药典9001 |
2015版中国药典9001 |
|
一、试验基本要求 |
影响因素试验批次 |
用1批原料药物或1批制剂进行;如果试验结果不明确,则应加试2个批次样品。生物制品应直接使用3个批次。 |
用1批原料药物或1批制剂进行。
|
|
生产规模 |
药物制剂每批放大试验的规模,至少是中试规模。大体积包装的制剂。如静脉输液等, 每批放大规模的数量通常应为各项试验所需总量的10 倍。
|
制剂如片剂、胶囊剂,每批放大试验的规模,片剂至少应为10000片,胶囊剂至少应为10000粒。大体积包装的制剂如静脉输液等,每批放大规模的数量至少应为各项试验所需总量的10倍。 |
|
|
通透性容器内的药物制剂 |
应当考虑药物的湿敏感性或可能的溶剂损失。 |
N/A |
|
|
制剂质量的“显著变化”定义 |
①含量与初始值相差5%; 或采用生物或免疫法测定时效价不符合规定。②降解产物超过标准限度要求。③外观、物理常数、功能试验(如颜色、相分离、再分散性、粘结、硬度、每揪剂量)等不符合标准要求。④ pH 值不符合规定。⑤ 12 个制剂单位的溶出度不符合标准的规定。 |
N/A |
2020年版药品稳定性试验指导原则之“原料药的影响因素试验
|
项目 |
试验条件 |
2020版中国药典9001 |
2015版中国药典9001 |
||
|
二、原料药 |
影响因素试验 |
考察方式 |
将供试品置适宜的开口容器中(如称量瓶或培养皿) ,分散放置,厚度不超过3mm( 疏松原料药可略厚)。
|
将供试品置适宜的开口容器中(如称量瓶或培养皿),摊成≤5mm厚的薄层,疏松原料药物摊成≤10mm厚的薄层。 |
|
|
高温试验 |
供试品开口置适宜的恒温设备中,设置温度一般高于加速试验温度10℃以上,考察时间点设定为0 天、5 天、10 天、30 天等取样,若供试品质量有明显变化,则适当降低温度试验。
|
供试品开口置适宜的洁净容器中,60℃温度下放置10天,于第5 天和第10天取样,若供试品含量低于规定限度则在40℃条件下同法进行试验。若60℃无明显变化,不再进行40℃试验。 |
|||
|
强光照射试验 |
光源种类 |
可选择输出相似于D65/ID65发射标准的光源,或同时暴露于冷白荧光灯和近紫外灯下。 |
供试品开口放在装有日光灯的光照箱或其他适宜的光照装置内。 |
||
|
照度 |
在照度为4500lx±500lx的条件下, 且光源总照度应不低于1.2×106lux•hr、近紫外灯能量不低于200W•hr/m²。 |
于照度为4500lx±500lx的条件下放置10天,于第5 天和第10天取样。 |
|||
|
PH值 |
原料药在溶液或混悬液状态时,或在较宽pH值范围探讨pH值与氧及其他条件应考察对药物稳定性的影响,并研究分解产物的分析方法。 |
根据药物的性质必要时可设计试验,探讨pH值与氧及其他条件对药物稳定性的影响,并研究分解产物的分析方法。 |
|||
|
其他 |
创新药物应对分解产物的性质进行必要的分析,冷冻保存的原料药物,应验证其在多次反复冻融条件下产品质量的变化情况。在加速或长期放置条件下已证明某些降解产物并不形成,则可不必再做降解产物检查。 |
创新药物应对分解产物的性质进行必要的分析。 |
|||
2020年版药品稳定性试验指导原则之“原料药的加速试验和长期试验”
|
项目 |
试验条件 |
2020版中国药典9001 |
2015版中国药典9001 |
|
|
二、原料药 |
加速试验 |
试验条件 |
在至少包括初始和末次等的3个时间点(如0、3、6月)取样。 |
在试验期间第1个月、2个月、3个月、6个月末分别取样一次。 |
|
中间试验条件 |
如在25℃±2℃、相对湿度60%±5%条件下进行长期试验,当加速试验6个月中任何时间点的质量发生了显著变化,则应进行中间条件试验。中间条件为30℃±2℃、相对湿度65%±5%,建议的考察时间为12个月,检测至少包括初始和末次等的4个时间点(如0、6、9、12月)。 |
如6个月内供试品经检测不符合制订的质量标准,则应在中间条件下即在温度30℃±2℃ 、相对湿度65%±5% 的情况下(可用Na2Cr04 饱和溶液,30℃,相对湿度64.8% )进行加速试验,时间仍为6个月。 |
||
|
温度敏感 |
预计只能在冰箱中(5℃±3℃)保存,加速试验条件25℃±2℃、相对湿度60%±5%。 |
预计只能在冰箱中(4~8℃)保存,加速试验条件25℃±2℃、相对湿度60%±10%。 |
||
|
冷冻贮藏 |
应对一批样品在5℃±3℃或25℃±2℃条件下放置适当的时间进行试验。 |
N/A |
||
|
长期试验 |
试验条件 |
供试品在温度25℃±2℃,相对湿度60%±5%的条件下放置。 |
在温度25℃±2℃,相对湿度60%±10%的条件下放置。 |
|
|
温度敏感 |
可在温度5℃±3℃的条件下放置。 |
可在温度6℃±2℃的条件下放置。 |
||
|
冷冻贮藏 |
可在温度-20℃±5℃的条件下至少放置12 个月进行考察。 |
N/A |
||
2020年版药物稳定性试验指导原则之“药物制剂的加速试验和影响因素试验”
|
项目 |
试验条件 |
2020版中国药典9001 |
2015版中国药典9001 |
|
|
三、药物制剂 |
影响因素 |
考察方式 |
除去外包装,并根据试验目的和产品特性考虑是否除去内包装, 置适宜的开口容器中,进行高温试验、高湿试验与强光照射试验,对于需冷冻保存的中间产物或药物制剂, 应验证其在多次反复冻融条件下产品质量的变化情况。 |
除去外包装,置适宜的开口容器中,进行髙温试验、高湿度试验与强光照射试验。 |
|
考察条件 |
同原料药。 |
同原料药。 |
||
|
加速试验 |
基本试验条件 |
供试品在温度40℃±2℃、相对湿度75%±5%的条件下放置6个月,在至少包括初始和末次等的3个时间点(如0、3、6月)取样。 |
供试品在温度40℃±2℃、相对湿度75%±5% 的条件下放置6 个月,在试验期间第1个月、2个月、3个月、6个月末分别取样。 |
|
|
中间试验条件 |
如在25℃±2℃、相对湿度60%±5%条件下进行长期试验,当加速试验6个月中任何时间点的质量发生了显著变化,则应进行中间条件试验。中间条件为30℃±2℃、相对湿度65%±5%,建议的考察时间为12个月,应包括所有的稳定性重点考察项目,检测至少包括初始和末次等的4个时间点(如0、6、9、12月)。 |
如6个月内供试品经检测不符合制订的质量标准,则应在中间条件下即在温度30℃±2℃ 、相对湿度65%±5% 的情况下进行加速试验,时间仍为6个月。
|
||
|
温度敏感 |
预计只能在冰箱中(5℃±3℃)保存,此种药物的加速试验,可在温度25℃±2℃、相对湿度60%±5%的条件下进行,时间为6个月。 |
预计只能在冰箱(4~8℃)内保存使用,此类药物制剂的加速试验,可在温度25℃±2℃、相对湿度60%±10%的条件下,时间为6个月。 |
||
|
冷冻贮藏 |
应对一批样品在5℃±3℃或25℃±2℃条件下放置适当的时间进行试验。 |
N/A |
||
|
长期试验 |
基本试验条件 |
供试品在温度25℃±2℃,相对湿度60%±5%的条件下放置12个月, 或在温度30℃±2℃、相对湿度65%±5%的条件下放置。 |
供试品在温度25℃±2℃,相对湿度60%±10%的条件下放置12个月, 或在温度30℃±2℃、相对湿度65%±5%的条件下放置。 |
|
|
温度敏感 |
可在温度5℃±3℃的条件下放置。 |
可在温度6℃±2℃的条件下放置。 |
||
|
冷冻贮藏 |
可在温度-20℃±5℃的条件下至少放置12 个月,货架期应根据长期试验放置条件下实际时间的数据而定。 |
N/A |
||
|
其他 |
所有制剂,应充分考虑运输路线、交通工具、距离、时间、条件(温度、湿度、振动情况等〉、产品包装(外包装、内包装等)、产品放置和温度监控情况(监控器的数量、位置等)等对产品质量的影响。 |
N/A |
||
|
有些药物制剂还应考察临用时配制和使用过程中的稳定性。例如,应对配制或稀释后使用、在特殊环境(如高原低压、海洋高盐雾等环境)使用的制剂开展相应的稳定性研究,同时还应对药物的配伍稳定性进行研究,为说明书/标签上的配制、贮藏条件和配制或稀释后的使用期限提供依据。 |
有些药物制剂还应考察临时配制和使用过程中的稳定性。
|
|||
2020年版原料药物及制剂稳定性重点考察项目差异对比表
|
项目 |
剂型 |
2020年版稳定性重点考察项目 |
剂型 |
2015年版稳定性重点考察项目 |
|
四、原料药物及制剂稳定性重点考察项目差异对比表 |
气雾剂(非定量) |
不同放置方位(正、倒、水平〉有关物质、折射速率、揿出总量、泄漏率 |
气雾剂 |
递送剂量均一性、微粒子剂量、有关物质、每瓶总揿次、喷出总量、喷射速率 |
|
气雾剂(定量) |
不同放置方位(正、倒、水平〉有关物质、递送剂量均一性、泄漏率 |
|||
|
喷雾剂 |
不同放置方位(正、水平)有关物质、每喷主药含量、递送剂量均一性(混悬型和乳液型定量鼻用喷雾剂) |
喷雾剂 |
每瓶总吸次、每喷喷量、每喷主药含量、递送速率和递送总量、微细粒子剂量 |
|
|
吸入气雾剂 |
不同放置方位(正、倒、水平)有关物质、微细粒子剂量、递送剂量均一性、泄漏率 |
吸入制剂 |
递送剂量均一性、微细粒子剂量 |
|
|
吸入喷雾剂 |
不同放置方位(正、水平)有关物质、微细粒子剂量、递送剂量均一性、pH值、应考察无菌 |
|||
|
吸入粉雾剂 |
有关物质、微细粒子剂量、递送剂量均一性、水分 |
|||
|
吸入液体制剂 |
有关物质、微细粒子剂量、递送速率及递送总量、pH值、含量、应考察无菌 |
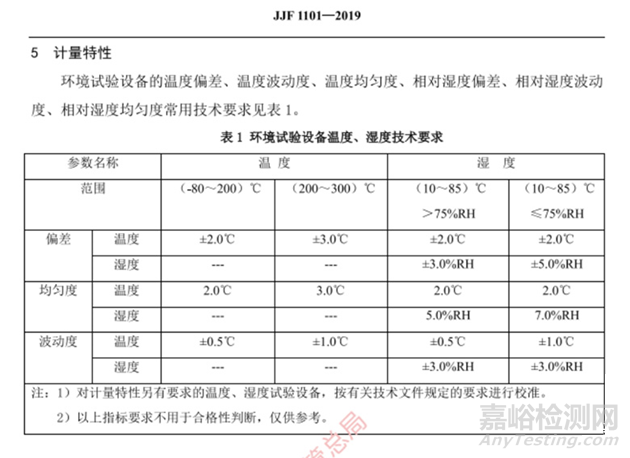
编者语:我们注意到,在稳定性试验研究中,涉及到恒温恒湿箱(试验设备)的温湿度分布的PQ验证遵守的标准JJF1101-2019也于2020年3月开始实施。我们也对比下供大家参考
|
序号 |
项目 |
JJF1101-2019 |
JJF1101-2003 |
|
1 |
温湿度技术要求表 |
以上指标要求不用于合格性判断,仅供参考 |
N/A |
|
2 |
适用范围 |
适用于温度范围(-80~300)℃、湿度范围(10~100)%RH的恒温恒湿箱等环境试验设备温度、湿度参数的校准 |
适用于环境试验设备温度、湿度计量性能的校准 |
|
3 |
引用文献 |
GB/T 5170.1-2016 GB/T 5170.2-2017 GB/T 5170.5-2016 |
GB/T 2423.4-1993 |
|
4 |
湿度测量标准 |
多通道湿度显示仪表或多路湿度测量装置 |
干湿球温度计/数字湿度计 |
|
5 |
测量仪器技术要求 |
温度误差:≤±0.15℃;湿度误差:≤±2%RH |
N/A |
|
6 |
数据处理 |
温度、湿度偏差和波动度的计算为设备里的任意点 |
温度、湿度偏差和波动度的计算为设备里的中心点 |
|
7 |
温度、湿度技术要求 |
环境试验设备温度湿度的波动度及均匀度要求变化(详见列表) |
湿度要求两项重复,产生歧义(详见列表) |
|
8 |
温湿度校准点的选择 |
温度、湿度校准点一般根据用户需要选择常用的温度、湿度点进行 |
一般应选择设备使用范围的下限、上限和中间点 |
|
9 |
布点位置 |
各布点位置与设备内壁的距离为各边长的1/10 |
测试点位置与内壁的距离不小于各边长的1/10 |
|
10 |
测试分布点 |
设备容积小于0.05m3或大于50m3时,可适当减少或增加测试点数量,并图示说明 |
当工作容积大于50m3时,测试点可适当增加 |
|
11 |
温度、湿度的校准 |
记录16组数据 |
记录15组数据 |
|
12 |
开始记录的时间 |
设备达到设定值后60min内 |
N/A |
|
13 |
温度偏差 |
各测量点在规定时间内实测最高温度和最低温度与设定温度的上下偏差 |
显示温度平均值与中心点实测温度平均值的差 |
|
14 |
湿度偏差 |
各测量点在规定时间内实测最高湿度和最低湿度与设定湿度的上下偏差 |
显示湿度平均值与中心点实测湿度平均值的差 |
|
15 |
温度波动度 |
工作空间任意一点温度随时间的变化量,实测最高温度与最低温度之差的一半,冠以“±”号,取全部测量点中变化量的最大值作为温度波动度的校准结果 |
工作空间中心点温度随时间的变化量。实测最高温度与最低温度之差的一半,冠以“±”号 |
|
16 |
湿度波动度 |
工作空间任意一点相对湿度随时间的变化量。实测最高湿度与最低湿度之差的一半,冠以“±”号,取全部测量点中变化量的最大值作为湿度波动度的校准结果 |
工作空间中心点温度随时间的变化量。实测最高湿度与最低湿度之差的一半,冠以“±”号 |
|
17 |
温度湿度均匀度 |
无变化 |
无变化 |
|
18 |
复校时间间隔 |
建议复校间隔时间为一年 |
建议最长不超过 2年 |
|
19 |
其它 |
详见附录 |
详见附录 |

来源:兰贝石/研如玉


