您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-06-30 11:43
前言
对于药学领域的方法验证ICH、药典委员会、CDE等权威机构都有相应的指导原则,虽然内容各有不同,但总的思路和原则其实是一致的。指导原则写的是一些很宽泛的指南性的内容,很少涉及具体操作以及为什么要这么做。笔者撰写本文的目的就是根据自己的经验和理解,深入剖析每个验证概念的含义,详细说明方法验证应该怎么做,为什么要这么做,以此为新进入药学研究领域的同仁解决所以然的问题。目标定这么大,而能力又实在有限,不当之处在所难免,敬请方家指正。以下具体操作过程及相应数值,可以作为参考,并不一定适用于所有情况。
一、专属性
1.概念解析
专属性系指在其他成分(如杂质、降解产物、辅料等)存在下,采用的分析方法能正确测定被测物的能力。
这句话的意思是被测物在其他成分的干扰存在下,依然能得出合理的结果。除去被测物之外,所有其他成分都是干扰源,以含量测定(外标法)为例,被测物是主成分峰,除此之外的供试品溶液中的一切其他成分都是干扰,包括稀释剂、辅料、有关物质、无机盐、残留溶剂等等。研究不可能覆盖所有的可能性,只需要研究高风险因素,一般来说稀释剂、辅料和有关物质是专属性的高风险因素。
2.怎么做?为什么?
1)主成分峰纯度
在专属性验证的相关实验中,主成分峰都应该考察峰纯度,确认主成分峰为单一成分的峰。具体做法是用DAD检测器进行峰纯度扫描或者用LC-MS确认没有其他成分。
2)稀释剂
应考察稀释剂对被测物的干扰,空白稀释剂出的峰应不干扰被测物。具体做法是按照质量标准规定的进样量检测空白稀释剂,记录色谱图。
3)辅料
取质量标准规定量的供试品中等量的空白辅料,按照规定分析处理,记录色谱图,空白辅料峰应不干扰被测物。
4)有关物质
有关物质分为两大块:工艺杂质和降解杂质。如果在二者均可获得的情况下,将杂质分别定位,并配制一份混合溶液,根据检测内容的不同分别研究。含量测定各杂质峰应不干扰主成分的检测,即各杂质峰应和主成分峰达成基线分离,各杂质峰之间没有要求,重叠也无妨,因为含量测定只需确认主成分峰不受干扰即可。有关物质中各杂质峰和主成分峰之间的分离度均应符合要求,一般不小于1.5。特殊情况可将某些杂质合并控制,如互为对映异构体的非对映异构体,它们在反相色谱法中一般都是重叠的峰。
如降解杂质不可获得,应进行酸碱氧化破坏条件下考察可能的降解杂质的干扰,该实验一般都做,但不是必须做,如果已经对降解杂质有了充分的研究,就无需做破坏实验。例如已经有了有效期内长期稳定性的研究结果,确认了稳定性期间的实际降解杂质。因为有些情况下,破坏实验的结果不是真实可能的降解杂质,这种情况以双氧水进行氧化破坏最为常见,破坏产物杂乱无章,甚至有可能因为该实验推翻分析方法。降解实验室一个很大的内容,所以在下个章节详细论述,需要注意降解实验应归属在专属性验证项下。
二、降解实验
降解实验的做法各相关指导原则都没有提出具体的措施,所以各个实验室做法各有不同,本文阐述的是个人看法,并力图证明其合理性。
为尽量避免降解实验产物与实际可能产生的降解杂质的不一致的可能,降解实验应为长时间弱条件下进行。本人不建议用强条件如高浓度酸碱和双氧水并辅助加热等做法,因为强条件下可能会形成二次降解产物,并出现许多降解产物峰,增加方法验证的难度,而实际稳定性期间出现的降解杂质可能就一两个甚至没有。
降解实验的目的为了预测稳定性期间的降解杂质,不是为了破坏而破坏。比如有说法应将主成分破坏5%-20%之间,但是一般条件破坏不了,就加强条件,必须在这范围内。而这是没有必要的,也是不合理的。以下内容详细论述我的降解实验的一般做法,个人见解,仅供参考。
1.破坏条件与操作
配制一份5/10倍浓度的供试品储备液,分别取5ml置25/50ml量瓶中,分别加入0.1mol/l盐酸溶液、0.1mol/l氢氧化钠溶液、0.1%双氧水溶液(如氧化破坏杂质多而乱,可考虑更弱的条件,如溶液中充氧气饱和)5ml,室温放置1天,酸、碱分别加等量碱、酸中和,再分别加稀释剂稀释至刻度。
另分别取0.1mol/l盐酸溶液、0.1mol/l氢氧化钠溶液、0.1%双氧水溶液5ml置量瓶中,同法操作,作为各破坏条件下的空白。如为制剂,应同法做空白辅料的破坏实验。
取上述5/10倍浓度的供试品储备液5ml置25/50ml量瓶中,加稀释剂至刻度,作为供试品溶液。
分别取上述溶液,按照质量标准规定进行分析,记录色谱图。
注意:酸、碱和双氧水溶液浓度和放置时间均可以根据破坏情况进行调整,如某个条件有降解倾向,应调节条件使破坏至5%-20%之间。如三者均未发现降解倾向,再放置一段时间如10天,依然如此,既可说明本化合物非常稳定,稳定性期间应不会产生降解杂质。本人有一个项目按此条件做破坏,均未产生破坏产物,长期稳定性试验2年,有关物质检测结果和0天分毫不差。
2.数据报告
1)峰纯度
各条件下的峰纯度应符合要求。
2)分离度
含量测定方法各破坏产物应与主成分达成基线分离,有关物质方法各破坏产物与主成分、现有杂质之间的分离度均应不小于1.5。
3)质量守恒
有关物质检测方法需要做质量守恒的验算,应评估主成分减少的量与杂质增加的量的一致性。理论上如主成分减少10%,杂质应增加10%,才能说明有关物质方法能准确检出所有的降解杂质。如二者不一致,则证明方法有缺陷,或为降解杂质未检出,或为降解杂质研究不充分,因为没有获得主要降解杂质的对照品,不清楚主要降解杂质的校正因子。
4)质量守恒验算方法
如主成分峰在线性范围内,可将供试品溶液的主峰峰面积和校正后的总杂质峰面积之和A供除以与破坏后的溶液主峰峰面积和校正后的总杂质峰面积之和A破,其限度应在98%-102%之间。即A供/A破的值应在98%-102%之间。制定此限度的依据是药典液相系统适用性实验连续进样5针,允许RSD不大于2%,也即数据2%以内的误差可以归属为仪器引入。
如主成分不在线性范围内,则可测定供试品溶液和破坏后的溶液的主成分含量和有关物质,含量减少值除以有关物质增加值,限度应在90%-110%之间。制定这个依据源自校正因子0.9-1.1之间都可不加校正因子计算有关物质,表明杂质结果允许10%的误差。
以上两个限度非官方规定,为合理限度,仅供参考,实际工作中可根据情况进行调整,本文中涉及的大部分数字都是如此。
3.补充说明
降解实验可以有关物质和含量测定同时做,二者可以共用同一份破坏样品,减少工作量,一般来说有关物质的供试品浓度大于含量测定,可以将有关物质破坏后的溶液稀释至含量测定规定浓度。具体如何操作请读者诸君自己设计。
三、准确度
1.概念解析
准确度系指采用该方法测定的结果与真实值或参考值接近的程度,一般用回收率(% )表示。回收率实验一般在有关物质、残留溶剂、制剂含量测定中较为常见,因为需要考察被测物在有其他成分的干扰情况下准确检测的能力,如有关物质会收到主成分的干扰,制剂含量测定受到辅料干扰等。回收率实验在原料药含量测定却是一种无法操作的尴尬处境。用原料药对照品标定没有任何干扰的原料药对照品自己?下文将阐述准确度验证的操作方法。
2.含量测定准确度
1)制剂含量测定
一般平行配置三份10倍浓度对照品储备液,分别取8、10、12ml置于预先加入相应量的空白辅料的100ml量瓶中,稀释制成80%、100%、120%的供试品浓度的9份溶液,取其中两份10倍浓度对照品储备液制成对照品溶液,分别取上述溶液按质量标准进行分析处理,按外标法计算得出上述9份溶液的含量,再除以对照品实际加入量,得出回收率数据,回收率应符合规定。
为什么是验证80%、100%、120%的供试品浓度溶液,而不是其他?这是因为质量标准中规定的是“取相当……约…….mg”,也就意味着供试品浓度一般在100%±10%范围内,即使考虑仪器和操作误差,那么80%-120%的区间一定包括了实际检测过程中供试品浓度所在的区间,再大的区间没有必要。含量测定的线性范围原因同样如此,溶出度线性范围和准确度范围与此不同。
2)原料药含量测定
一般来说,不具有可操作性,所以我在实际工作中不进行相关验证。因为指导原则有原文指出“准确度也可由所测定的精密度、线性和专属性推算出来”,也就是说如果精密度、线性和专属性验证均符合要求,则准确度必定符合要求,无需验证。但总有人担心审评老师找麻烦,硬是要做这个,就推荐两个我所知的同仁的做法供大家参考。
一是9份准确度溶液中原料药和原料药对照品各一半,另外一种做法是用原料药对照品按外标法计算原料药对照品的含量,其结果和对照品的标定值做对比。
3.残留溶剂准确度
以最常用的顶空进样法为例,配制一份2倍浓度供试品储备液,取质量标准中1/2体积的储备液分别置10个顶空瓶中。其中一份加入1/2体积的稀释剂,作为供试品溶液。配制一份10倍浓度对照品溶液,稀释制成50%、80%、100%规定浓度的2倍储备液(该项可以商酌,个人认为溶剂残留超标即不合格,超过100%准确度可不验证)1/2体积,分别加入上述剩余9个顶空瓶中,作为准确度检测溶液。另取10倍浓度对照品溶液,稀释制成100%规定浓度溶液,作为对照品溶液。依法测定,计算供试品与准确度检测溶液溶剂残留值,二者之差除以对照品实际加入值,回收率应符合规定。
4.有关物质准确度
分别配制一份10倍浓度供试品溶液与规定限度杂质对照品混合储备液,取5ml供试品储备液置50ml量瓶中,加稀释剂稀释至刻度,作为供试品溶液。如为自身对照法,依法配制对照液。取供试品储备液5ml,分别置9个容量瓶中,分别加入适量杂质对照品混合储备液制成50%、100%、150%限度各三份的准确度溶液。取上述溶液,依法测定,计算供试品已有杂质含量、加杂准确度溶液杂质含量,二者之差除以杂质对照品实际加入量,即为回收率,应符合规定。
需要注意的是,有关物质准确度的数据应该按照质量标准规定处理,例如质量标准规定为加校正因子的自身对照法,则应该按照质量标准的规定计算各样品溶液的杂质含量,并计算回收率。举例如下:在5mg的供试品溶液中加入了5μg的杂质,实际加入量为0.10%,供试品该杂质的本底量为0.01%,加杂后根据加校正因子的自身对照法计算实测值为0.105%,则回收率=(0.105-0.01)/0.10=95%。偶见用外标法计算有关物质的回收率,而质量标准规定的是自身对照法。这背离了方法验证的本意,方法验证应该验证方法自身的准确度。如果用外标法回收率合格,但线性验证出现问题,校正因子计算不准确,导致实际工作中检测结果偏离真实值,而方法验证却判断符合要求,这明显是不合理的。
5.其他
如溶出度、异构体、某些基因毒性杂质等检测方法的准确度验证,限于篇幅所限,不再一一列举,但都可以参照以上做法的思路设计实验方案。
四、定量限与检测限
1.定量限
定量限系指试样中的被分析物能够被定量测定的最低量,其测定结果应具有一定的准确度和精密度。从这一概念出发,应确定信噪比为10的供试品的浓度是理所当然的。然而响应情况随着仪器与流动相的不同而不同,在方法验证时所选仪器与流动相得出的信噪比为10的供试品的浓度不具有普遍意义上的代表性,这只是一个偶然值。我们在实际工作中其实无需确定信噪比为10的供试品的浓度,只需证明方法需定量的限度的合理性。以下举例说明:若方法报告限规定为0.05%,那么肯定需要证明此限度能准确定量,如不能准确定量,则此项规定不合理。我们可以稀释制成0.01%的相应溶液,注入仪器检测,其信噪比如大于10,则证明方法有合理的定量限。无需费时费力找出每个杂质的信噪比10的浓度,特别是已知杂质数量较多的情况下,工作量将极为巨大。直接稀释至特定浓度考察信噪比,则非常简单,只需将线性验证项下的混合杂质溶液稀释至目标浓度即可。
还有一种简单的计算LOQ的方法就是根据线性验证的结果计算,公式为LOQ=10×STEYX/斜率,STEYX为线性数据的剩余标准偏差,可以用EXCEL直接算出这个值。
LOQ浓度样品应连续进样6次,考察响应的精密度。
2.检测限
可将上文举例的0.01%溶液稀释2-5倍直接考察信噪比,大于3即可。也可由公式LOD=3.3×STEYX/斜率计算得出检测项浓度。
五、线性与范围
该项验证各指导原则已经有较为详细的说明,故没有太多论述的必要。我在此仅说明一下进行此项需要注意的地方。在有关物质线性验证中,除面积归一法之外,范围不宜太宽,否则相关系数较差,截距较大。如果波长较小,接近流动相截止波长,则流动相本底吸收较大,则更要缩小线性验证的范围。每个点峰面积为供试品实际响应值减去流动相本底值。日常工作中细心的同志应该能发现在高流动相本底吸收的低浓度下响应远小于高浓度响应除以相应稀释倍数的值,就是由于流动相本底的影响。一般有关物质线性范围可以是限度的20%、50%、80%、100%、120%、150%。还需注意的是线性范围应包括准确度的三个值。
六、耐用性
耐用性系指测定条件发生小的变动时,测定结果不受影响的承受程度。此概念看定义就能清楚理解,没有叙述的必要。故只提供一下本人在实际工作中的做法。一般来说耐用性每种条件变动,都应该考察系统适用性,证明系统适用性不受影响,如有关物质考察是否符合质量标准规定的分离度要求,含量测定考察进样精密度、拖尾因子等。我们可以与精密度验证同时进行,取精密度验证中其中一个样品为预定色谱条件,其他变动条件下测定该样品的结果与该样品在精密度项下的结果汇总统计分析。以含量测定为例,举例如下:
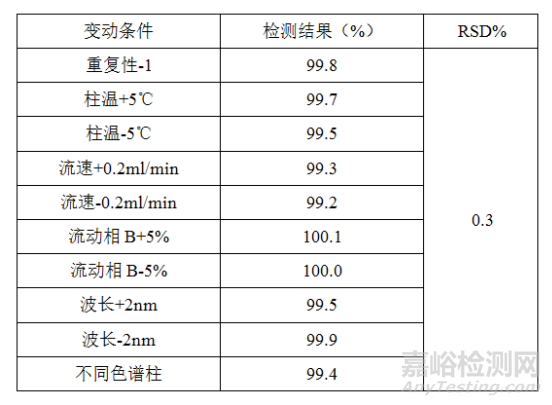
如某个条件变化系统适用性或检测结果不符合要求,则应研究更小的变化区间以使相关验证符合要求。如变化区间过小,则方法耐用性不佳,以后方法在不同实验室转移或者不同人员操作结果的重现性将存在巨大风险。
另外需要说明的是溶液稳定性也归属于耐用性验证项下,并非独立的验证项。时间的变化也属于条件的微小变化之一。一般取样时间点为2、4、8、12、16、24、36、48h,如果4小时后即不稳定,应在质量标准中规定临用新配。
耐用性为分析方法的挑战性验证,一个好的方法应能在合理的尽可能大的区间内符合验证要求,以便于今后工作的开展。如溶液有良好的稳定性,供试品溶液放置数天后仍然可以用来检测;柱温的要求很随意,即使柱温箱损坏也不影响检测的进行等等。
七、精密度
该项验证没有歧义较为简单,我也仅提出一些本人的看法。值得一提与讨论的是有关物质的精密度验证。如采用中试样品做重复性验证,测出某个杂质的6个值分别为:0.01%、0.01%、0.01%、0.01%、0.01%、0.02%,该方法的重复性好不好?在实际工作中这样的数据其实没有任何问题,并不影响对结果的判断,因为这可能只是0.014%和0.015%的差别,但由于2015年版中国药典四部在其指导原则中对有关物质精密度验证的RSD提出了近乎天方夜谭的要求,它要求必须计算RSD还必须满足它的要求。那么上述数据就完全不可能满足相应的限度要求。对于这种用强权强奸真理不顾客观事实一刀切的做法,我也只能无视了。RSD考察有关物质的精密度在上述数据中会显出一个非常高的数据,但是这其实并没有什么意义。有关物质检测结果的统计分析还可以用极差的方式,如认为实际工作中报告的结果±0.01%都可以接受,那么单杂的极差不大于0.02%,即可说明方法具有良好的精密度。
可能有些同仁还是不放心,因为审评老师可能不会那么讲道理,那我就推荐一种做法,即在供试品中加入限度规定量的杂质对照品,这样的话RSD将小很多。具体做法如下:分别配制一份10倍浓度供试品储备液与10倍浓度杂质储备液,各取2ml置同一20ml量瓶中,平行配制6份,以此作为精密度验证用样品。
八、后述
方法验证的题目取的有点大,写了很多,但发现还是有很多问题浅尝即止,未能深入阐述。再次重申,以上所有具体操作与限度值未必适用于所有情况,可以作为进行调整的参考,且为个人看法,非客观真理,能力所限,错误之处在所难免,欢迎撰文驳斥。

来源:占小兵/药事纵横


